马上注册,结交更多好友,享用更多功能,让你轻松玩转社区。
您需要 登录 才可以下载或查看,没有账号?注册
×
概要
背景
毫无疑问,机器人系统已经在很大程度上渗透到手术领域。对于任何新的手术方法成为传统方法的可接受的替代方法,必须证明它是安全的并且产生可比较的结果。本研究的目的是比较机器人辅助和腹腔镜直肠癌切除术的短期手术和肿瘤学结果。
方法
这是一项前瞻性随机临床试验,对2015年4月至2017年2月期间接受机器人辅助或腹腔镜手术的直肠癌患者进行了随访。分析患者的人口统计学特征,手术参数以及短期临床和肿瘤学结果。
结果
57名患者接受了置换区组随机化。在这些患者中,28人被分配接受机器人辅助直肠手术,29人接受腹腔镜直肠手术。在随机化后排除12名患者后,将45名患者纳入分析。两组在年龄,性别,BMI,ASA评分,临床分期和接受前期化放疗率方面无显著差异。估计机器人的失血量明显低于腹腔镜组(中位数:200对325毫升,p = 0.050)。机器人中的远端边缘明显多于腹腔镜组(中位数:2.8对1.8,p <0.001)。虽然机器人组的18名患者(85.7%)的圆周径向边缘(CRM)完成,而腹腔镜组的15名患者(62.5%),但在统计学上没有差异(p = 0.079)。两组的术后并发症发生率相似。
结论
据作者所知,这是第一个在中东和北非地区进行机器人直肠手术的前瞻性随机试验。作者的早期经验表明,机器人直肠手术是一种可行且安全的手术。在肿瘤学根治性和手术并发症方面,它不逊于标准腹腔镜检查。组织编号是IORG0003381。 IRB编号为IRB00004025。
1.背景
在过去二十年中,直肠癌管理从各个角度经历了巨大的变革浪潮。有一个从开放灵活换档,以微创和机器人技术,新辅助多放化疗的局部晚期疾病在全球范围内的应用程序,以及优化手术技术与神经保留一起引进全直肠系膜切除术(TME),这这些都是在过去10到15年间发生的。第一次结肠直肠腹腔镜手术由Jacobs于1991年进行[1]。十年后,在2001年,机器人系统被引入结肠直肠手术[2]。
迄今为止,腹腔镜手术已被公认为直肠癌手术的安全有效方式。然而,一项随机对照多中心试验最近表明,在T3 / T4肿瘤中使用腹腔镜手术可能导致切除不完全,影响该组患者的肿瘤学结果[3]。当面临解剖学困难时,例如,狭窄的男性骨盆,笨重的肿瘤和肥胖患者,经常遇到腹腔镜手术中不完全TME的挑战。机器人直肠手术可能是这个窘境的答案。
为何选择机器人?达芬奇手术系统公司提供了许多理由,包括高清3D图像,腕部功能,震颤过滤,微吻合术,运动缩放和远程手术。尽管如此,作者仍然相信手术过程中存在某些明显的优势。首先是最佳,稳定的操作视图;外科医生不再依赖助理了。其次是高清3D图像,具有出色的可视化和区分,可以从要保留的内容中删除。此外,外科医生的手腕现已融入技术中,他或她可以在骨盆深处的空间内自由移动,这是他无法到达的地方。除此之外,使用连接到第四机械臂的第三机器人仪器,具有最佳方向和力的反作用可以是操作者。
随着微创手术取得进展,作者相信机器人手术将为直肠癌的治疗提供下一个重大进步。无论喜欢与否,机器人系统已经彻底改变了手术领域,在优越的可视化,增强的运动,人体工程学和可比较的临床结果方面证明了其优于腹腔镜技术的优势。
2.方法
这是一项前瞻性随机对照研究,对所有男女患者和明确年龄组的患者进行了国家癌症研究所的研究,以及距离肛门边缘15厘米的直肠腺癌患者,这些患者有资格参加本研究。肿瘤定位分为上直肠(肿瘤远端边缘距离肛门边缘10至15厘米),中间直肠(距肛门边缘5至10厘米)或下直肠(距离肛门边缘不到5厘米) )通过结肠镜检查和直肠指检测量。患者被分为两组:机器人辅助直肠手术“作者使用的机器人系统是da Vinci Si(Intuitive Surgical,Inc.,Sunnyvale,CA)”和传统的腹腔镜直肠手术。基线人口统计学(性别,年龄,ASA,BMI),术前数据(肿瘤距肛门边缘的距离,临床分期,术前化学放疗“CRT”,CRT后残留肿瘤的存在),术中数据(准备时间,实际手术)时间,估计失血量和开放手术转换率),术后数据(病理分期,淋巴结收集次数,近端边缘切除的宏观完整性,远端边缘和周缘径向边缘),以及术后即刻结果在一个月内(肠功能恢复天数,住院天数,并发症,如果有的话,如吻合口漏,肠梗阻,伤口问题等,再次手术率,再入院率和30天死亡率)进行分析和比较。
患者选择的标准如下:直肠腺癌的组织学诊断,微创手术没有麻醉禁忌症,年龄≤75岁,ASA≤2,以及由同一手术团队执行的手术。患有转移性疾病,恶性肠梗阻(MBO)和不可切除的肿瘤的患者被排除在作者的研究之外。
常规进行术前检查(内窥镜检查,活检,放射成像,包括盆腔MRI,肝脏超声检查,胸部X光检查,常规腹部和直肠指诊)。通过置换区组随机化将患者分配到任一组。这是一项开放标记的研究;即,患者,研究人员(外科医生,研究人员)和数据收集者知道将对哪些患者进行哪种手术。该研究得到了开罗大学NCI的机构审查委员会(IRB)的批准。所有患者均提供书面知情同意书。
关于术前准备;首先,对所有患者术前进行直肠灌肠机械性肠道准备。给予单次术前剂量的抗生素(口服环丙沙星750mg,静脉注射新霉素1克)。其次,从手术前的午夜开始,患者未接受已知会导致长期镇静的药物。第三,为了预防血栓栓塞,在预期的手术时间前12小时给予皮下依诺肝素40mg。第四,患者在手术前约1小时接受针对厌氧菌和需氧菌的单剂量抗生素预防。最后,固定饮食在手术前一天停止,没有饥饿政策,因为在手术前禁食4小时。
3.定义
当吻合分别在腹膜反射之上或之下进行时,定义前或前切除。在超低位前切除术中,移除整个直肠并进行结肠吻合术。准备时间是从麻醉诱导到控制台以及从控制台到皮肤闭合的实际操作时间计算的。只要最终病理阶段与术前临床阶段不同,就会发生阶段迁移。手术发病率以伤口感染,肠梗阻形式的并发症为特征。如果观察到以下任何特征,则认为存在临床吻合口漏:存在由吻合口裂开引起的腹膜炎,存在通过骨盆引流管排出的多种物质,或存在骨盆脓肿并伴有吻合口漏直肠检查或对比研究。
4.工作描述[4]
4.1.手术室安排
无论是机器人还是腹腔镜,都采用了一些原则:首先,患者以排除压力或神经损伤的方式定位,以便所有压力点都充分填充;第二,患者固定在手术台上以防止滑动,因此胸带的位置优于剑突,腿带也适用于气动小腿;第三,通过定位IV线,心脏监测导管和导尿管以不妨碍手术团队的手术区域的方式释放手术区域。
4.2.患者定位
患者被置于改良的截石位置,两臂都被折叠。 患者的腹部和骨盆是从剑突到耻骨联合以及从右腋后线到左腋后线制备的。 在患者被放置在垂头仰卧位后,右侧向下倾斜并且左腿降低到足以避免在对接期间发生碰撞时,总是采用倾斜角度(在臀部上方)左对接,图1。
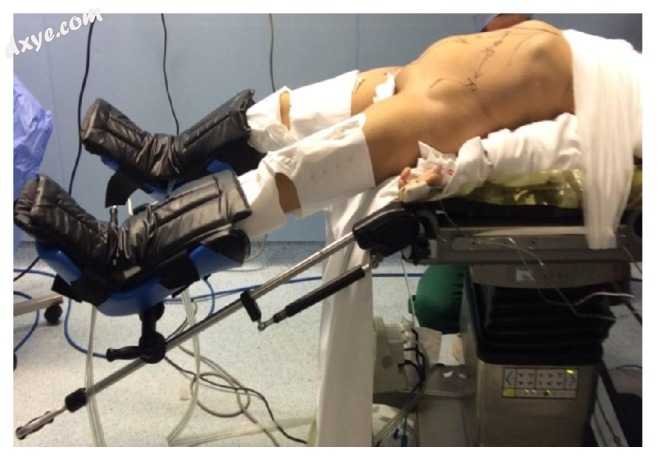
图1
改良Lloyd-Davis位。
4.3。 标记和套管放置
作者采用完全机器人方法,因此套管针被放置在右下和左下象限(分别为第1和第2臂),大约在锁骨中线。 手臂3放置在左侧腹部,刚好位于髂前上棘。 另外一个5毫米套管针(辅助端口)放置在右上象限中,如图2所示。作者避免将套管针放置在横向太远的位置(特别是在男性患者身上),因为与骨盆侧壁的碰撞会使骨盆解剖很困难。 在脐部上方和右侧的中线,作者放置了始终为30度相机的相机端口。 一旦实现吹气,就放置额外的套管针以确保端口之间适当的8-10cm距离。
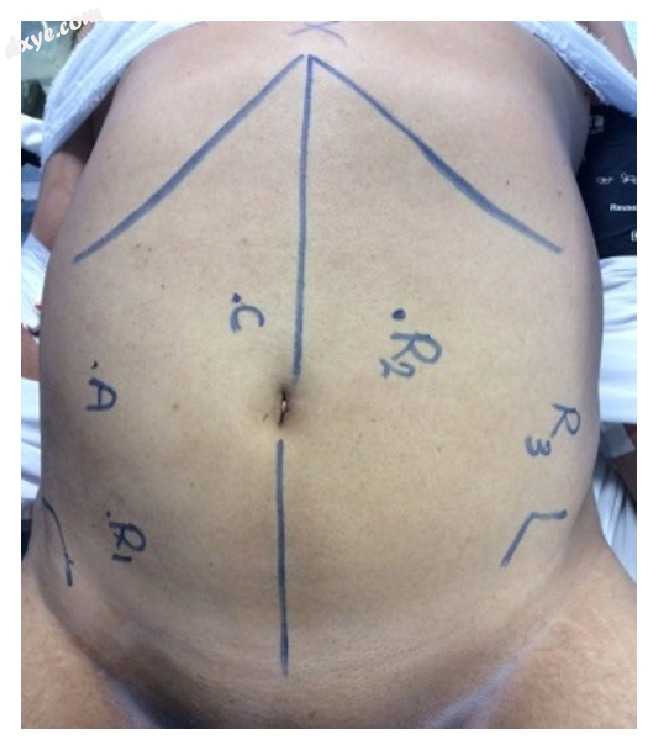
图2
标记。
4.4.机器人技术
4.4.1.腹部阶段(第1部分)
将患者置于陡峭的垂头仰卧位置,右侧向下倾斜,使小肠和大网膜向右上象限和肝脏反射。作者更倾向于女性患者通过子宫底部直接穿过缝合线来悬吊子宫,以便无阻碍地看到骨盆。首先在手臂1中使用单极剪刀,在手臂2中使用有孔的双极钳,并且在手臂3中设置双有孔的无创伤性肠抓握器。利用臂3,将直肠乙状结肠接合处理。相反,右手可以在该区域上获得一个手柄,允许手臂3在直肠上更远侧地获得手柄以给予作者额外的牵引力。
解剖沿着直肠系膜的后部朝向IMA向上传递,考虑不破坏直肠的筋膜固定并避免损伤上腹下神经。作者特别解剖肠系膜下动脉路线下方和腹膜后筋膜平面,左输尿管和性腺血管。输尿管和性腺血管可以简单地在外侧骨盆壁和骨盆边缘上区分。 IMA从腹膜后升高,输尿管和性腺血管可以毫不费力地向后直接扫过,以便在腹膜后,IMA的背部和侧面保持其状态。作者要么控制IMA,IMV用剪辑,缝合线,要么用谐波控制。结肠肠系膜现在能够从近端和侧面从腹膜后提起。解剖的程度优于胰腺的下缘和横向覆盖Gerota筋膜。现在,人们可以通过从骨盆边缘开始并向近端朝向脾弯曲继续快速脱离与左结肠和乙状结肠的外侧腹膜连接。
4.4.2.腹部阶段(第2部分)
在腹部阶段的第2部分,作者处理释放左结肠曲。将双孔的无创伤抓紧器置于手臂1中;根据需要将单极弯曲剪刀和双极有孔抓握器放置在臂2和3中,以帮助以内侧到外侧的方式调动脾曲,使患者保持在相同位置。
4.4.3.骨盆期
作者通常沿着后侧,右侧开始解剖并且向尾侧进行,手臂2将直肠推向患者的左侧,并且利用手臂1进行解剖,该切除继续到左骨盆侧壁,如可以想象的那样减少从患者左侧需要解剖的是什么。在直肠筋膜后面远端继续进行后部解剖,留下完整的神经血管走行筋膜,以保护下腹部神经丛。在接近侧秆时,用单极烧灼切割它们。然后将注意力转向前部解剖。助手将直肠向下移出骨盆外。臂3通过向上和向前缩回而在精囊或阴道后部的水平上辅助张力。对于肿瘤累及后直肠壁的患者,作者的解剖平面始终位于Denonvilliers筋膜后面,以便将其与标本取出。对于前部肿瘤,作者的解剖平面几乎总是在其前面。
4.4.4.吻合技术
如果ECHELON FLEX™45 mm吻合器可以足够的边缘使用,则进行双吻合吻合术,用内窥镜吻合器切断直肠,并通过Pfannenstiel切口或左髂窝中的小切口取出标本案例。通过经肛门插入圆形吻合器进行体内吻合术。通过经肛气吹气常规检查吻合口。当内窥镜缝合器不能在肿瘤下方施加足够的边缘时,进行经肛门切除术和结肠手工缝合吻合术
转移循环回肠造口术常用于低位(低于前腹膜反射)吻合的患者或接受术前放射治疗的患者。对于回肠造口术逆转的考虑发生在指数手术后3个月或任何潜在的辅助治疗完成后。
4.4.5.术后策略
作者在这项工作中采用了针对直肠癌的机器人或腹腔镜方法的患者的强化恢复护理方案。实施术前咨询,充分的液体和疼痛管理,早期喂养和手术后的操作。患者在符合出院标准时出院,包括对口服饮食的耐受性,口服镇痛药的充分疼痛控制,患者独立行走,没有心动过速的无发热患者,无白细胞计数或C反应蛋白(CRP),以及足够的家庭支持。能够照顾造口。
5.统计分析
使用社会科学统计软件包(SPSS)与23进行数据管理和分析。使用中位数和范围汇总数值数据。分类数据总结为数字和百分比。使用Kolmogorov-Smirnov检验和Shapiro-Wilk检验研究数值数据的正态性。对数据的探索表明,所收集的数值并非正态分布。通过Mann-Whitney检验进行两组之间的比较。在适当的情况下,使用卡方或Fisher检验来比较各组之间的分类数据。所有p值都是双面的。 P值<0.05被认为是显著的。
6.结果
从2015年4月至2017年2月,共有57名直肠癌患者接受了置换阻滞随机化,图3.其中,28名患者接受机器人辅助直肠手术,29名接受腹腔镜直肠手术。由于不同原因(例如同意戒断,紧急手术或转移的存在)随机排除12名患者后,45名患者(机器人手术组21名,腹腔镜手术组24名)被纳入分析。
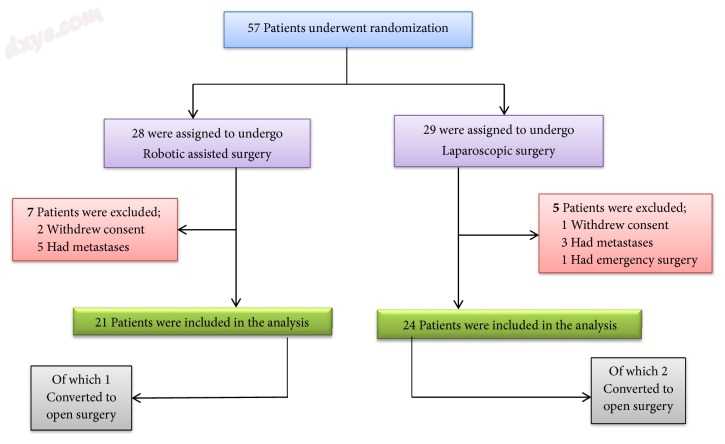
图3
患者登记。
患者人口统计数据和特性示于表1。有组间无差异显著在年龄,性别,BMI,ASA得分,临床阶段,从肛门边缘的肿瘤的距离,接收前期化放疗的速率,和速率方面术前治疗后无残留病灶机器人手术组患者的中位年龄为53.4岁(范围从32到67),而传统腹腔镜手术组患者的中位年龄为50.3岁(范围从36到64)(P = 0.241)。的患者在所述机器人组47.6%具有低于30千克/平方米的BMI,而其它52.4%具有BMI以上30。另一方面,大多数的患者在腹腔镜组(66%)具有BMI高于30,而其余33%低于30 kg / m2 BMI(P = 0.329)。虽然更多的男性患者接受了腹腔镜手术(机器人组为42.4%,腹腔镜组为54.2%),但性别方面存在显著差异。
表格1
患者人口统计学数据和特征。
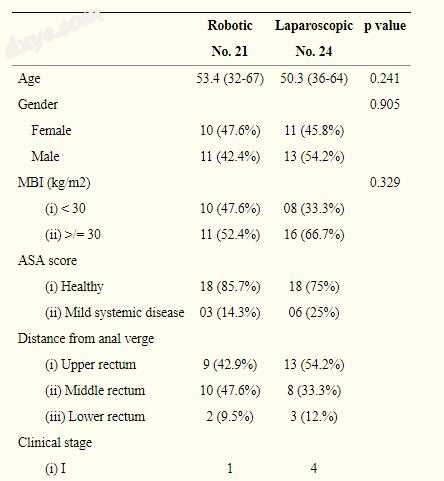
机器人组中的12名患者接受了前期治疗(57.1%),而腹腔镜组中的11名患者(45.8%)接受了p值0.449,并且每组中只有一名患者显示出完全的临床和放射学反应。
手术数据进行比较并记录在表2中。在机器人辅助手术组中,9例患者接受了前切除术(42.9%),7例接受了低位前切除术(33.3%),4例接受了超低位前切除术(19%),只有一名患者(4.8%)接受了腹部会阴切除术(APR)。另一方面,腹腔镜组,13例患者行前路切除术(54.2%),7例行低位前切除术(29.1%),1例行超低位切除术(4.2%),最后4例接受APR(12.5%)。准备时间(从麻醉诱导到控制台的时间)在机器人组中显著更长,中位数为五十五分钟,而腹腔镜组中的二十八分钟,p值小于0.001。相似性,机器人组的实际手术时间(从控制台到伤口闭合的时间)也更长,中位数为201分钟,而腹腔镜组为134.5分钟,统计学上显著的p值小于0.001。尽管临床上并不明显,但机器人组的估计失血量在统计学上显著低于腹腔镜组,中位数分别为200 ml和325 ml,p值为0.050。尽管作者在机器人结肠直肠手术方面的初步经验,但只有一例需要转为开放手术,而腹腔镜组只有两例。在I,II和III期的机器人组中有5例有阶段迁移,而在腹腔镜组中有8例,最后11例患者中有52.4%在II期,10例患者(47.6%)在III期,在机器人组。另一方面,腹腔镜组的17名患者(70.8%)和7名患者(29.2%)分别处于II期和III期。机器人组的中间远端边缘为2.8 cm,而腹腔镜组为1.8 cm。这在统计学上显著,p值小于0.001。虽然机器人组的18名患者(85.7%)的圆周径向边缘(CRM)完成,而腹腔镜组的15名患者(62.5%),但在统计学上没有差异,p值为0.079。在机器人和腹腔镜组中,检索到的淋巴结数量的中位数分别为14个与13个节点无统计学差异,p值为0.498。以类似的方式,两组在近端边缘的长度上没有差异。
表2
操作数据。
术后,表3中,机器人组第一次排气时间中位数为2天,腹腔镜组为1.6天;这在统计学上是显著的,p值为0.017。机器人组患者的住院时间中位数(LOS)为3天,腹腔镜组患者仅为2天。这是由于采用了快速通道协议,两组之间没有显著的统计学差异,p值为0.116。两组患者术后并发症的总体发生率无差异。每组吻合口漏一次;在机器人组中,泄漏很少并且保守地成功管理,但不幸的是在腹腔镜检查中,患者是48岁的中直肠癌女性,她接受了前期化放疗并且已知患有糖尿病并接受腹腔镜低位前路切除覆盖回肠造口术。在第1天发现泄漏,粪便物质通过排水管,一般状况迅速恶化。在充分复苏后,腹腔镜探查显示腹壁脏污后壁破裂。腹膜灌洗完成后,作者考虑了两种选择,既可以进行Hartman手术,也可以重新设计边缘并重新缝合两端,用现有的回肠造口术进行缝合和覆盖吻合术,后者选择了。作者认为足够的灌洗,引流和止血回肠造口术是足够的,但事情并不总是如你所愿。将患者转移至ICU,拔管。第二天,一般情况继续恶化,心动过速超过120 / min,呼吸急促,代谢性酸中毒,急性期反应物上升。她的双重研究,超声心动图和心肌酶检测未发现异常。病人在第三天死亡。在机器人手术组中,两名患者发生术后肠梗阻,而腹腔镜组为3名患者,两组均进行了保守治疗。感染或缝线破坏形式的伤口问题(在APR病例中)发生在四名患者中,两组之间平均分配。一名患者在机器人组中有DVT,在腹腔镜组中有一名患者抱怨勃起功能障碍。
表3
即刻术后结果。
机器人手术组未发生再次手术或死亡,只有一名患者在腹部会阴切除术后因会阴部伤口再次入院而再次入院。另一方面,由于发烧和胸部感染,一名患者在术后第3天再次入院,还有一名患者再次手术并且不幸死亡。
根据Clavien-Dindo对手术结果的分类,机器人组中的6名患者出现并发症,主要是一级,表4.一例患有深静脉血栓形成并使用抗凝血剂治疗。有证据表明骨盆采集的吻合口漏是另一例,该组保守治疗并采用影像引导下经皮引流。相比之下,腹腔镜组有7例出现并发症;其中五个在一年级和一个病例有长期麻痹性肠梗阻需要给予肠外营养。本研究中发生一次5级并发症,见表4
表4
根据Clavien-Dindo分类的并发症严重程度。
  
 
7.讨论
靠近点!别摇!留在这!右转!左边!这是机器人辅助手术和腹腔镜手术之间真正的实际差异之一,其中外科医生仍然是助手依赖。
毫无疑问,自二十一世纪初以来,直肠手术从不同角度经历了巨大的变革浪潮。从开放到微创和机器人技术的智能转变,全球应用新辅助多模式放化疗治疗局部晚期疾病,以及优化神经保留的手术技术以及全直肠系膜切除术(TME)的引入在过去的10到15年里,这一切都在很大程度上发生。
然而,腹腔镜直肠癌切除术是一个复杂的过程,具有较长的学习曲线,并且骨盆中的常规腹腔镜手术是困难的,特别是在深男性骨盆中肿块较大的情况下。因此,CLASICC试验中开放方法的转化率超过30%[5],而COLOR II试验中转化率为17%[6]。
对于任何新的手术技术成为传统方法的可接受的替代方法,必须证明它是安全的并且必须产生可比较的结果。例如,自从采用腹腔镜进行结肠直肠手术以来,已经出现了研究,这些研究表明它可以缩短住院时间,产生肿瘤学上足够的切除,与传统的开放式方法相比,术后并发症或住院死亡率没有明显差异。由于这些研究,腹腔镜检查现在被认为是结直肠切除术中开放入路的合理替代方法[7,8]。此外,其他评论已经证明机器人直肠手术是安全可行的[9-11],尽管没有已发表的研究证明其优于腹腔镜方法,主要是由于缺乏随机对照试验。
在作者的研究中,机器人组和腹腔镜组在年龄,性别,BMI,ASA,肛门边缘距离,术前临床分期和前期化放疗率方面无显著差异。本研究中的操作由一组经验丰富的腹腔镜外科医生和诚实的初学者机器人外科医生进行。毫不奇怪,作者承认腹腔镜直肠切除术具有挑战性,特别是对于骨盆狭窄的男性体积庞大的肿瘤,需要复杂的动作才能到达骨盆的极端。机器人辅助组的括约肌保留率高达19%,而腹腔镜组为4.2%,机器人辅助组只有一名患者(4.8%)进行腹会阴切除术,而近三倍(12.5%) %)在腹腔镜组。这种差异可归因于机器人平台的技术特征,最重要的是,使用连接到第四机械臂的大的第三机器人仪器,最佳稳定的操作骨盆视图,内部功能以及具有最佳方向和力的反作用力;当在手术期间解决骨盆时,与传统的刚性腹腔镜器械相比,这些当然是有利的。
至于转换率,由于在非常狭窄的男性骨盆中没有达到舒适的远端边缘的庞大的中直肠肿瘤,只有一个机器人病例被转换为开放入路;值得一提的是,这是该研究中的第二个机器人案例。另一方面,两例病例从腹腔镜入路转为开放入路。尽管在腹腔镜方法中转换率几乎翻了一番,但由于病例数较少,这在统计学上并不明显,但与Ielpo和同事[12]的结果相似,他们认为机器人方法在肿瘤时转化率较低位置要求低位前切除,因此,操作在技术上更具挑战性。在转化的病例中,发病率和肿瘤复发率增加[13],机器人手术可以提供更好的肿瘤学远期疗效以及降低围手术期发病率。
该试验的一个明显发现是机器人手术和腹腔镜手术的准备时间(图4)(中位时间55对28分钟)和实际手术时间(图5)(201对134.5分钟)分别较长,非常显著p值均小于0.001。即使在有经验的外科手术团队在场的情况下,这些结果也可以通过用于对接和取消机器人系统的时间来证明。手术台上的患者需要不同的位置并不常见,因此在同一手术过程中机器人手推车需要脱开并重新进行多次重新锁定。这延长了手术时间。毫无疑问,逐步外科手术的标准化以及整个手术团队(外科医生,护士,麻醉师和手术室工作人员)的持续培训可以提高手术质量并导致手术时间的逐步减少。从传统上讲,手术时间较长与发病率增加有关,很可能与手术难度有关[11];然而,机器人手术的长时间与本研究所宣称的以及之前发表的Luca及其同事的综述和荟萃分析所证实的并发症并不相关[14]。
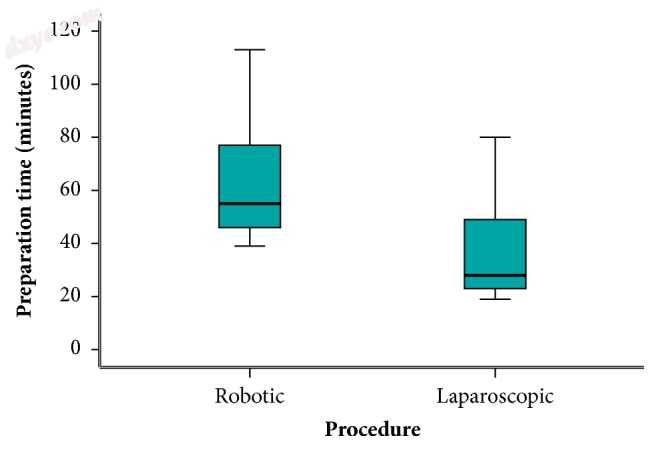
图4
准备时间。
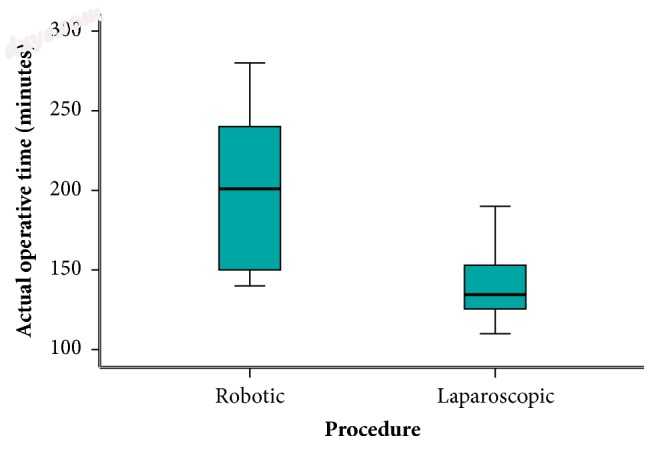
图5
实际操作时间。
这项随机试验报告了机器人直肠手术后估计的失血量显著降低(p值= 0.050)。最近一项病例对照分析比较了机器人和腹腔镜方法之间的TME,但没有显示出血量的任何显著差异[15]。一项单独的荟萃分析评估重申了这些发现[16]。收获的淋巴结数量在术后肿瘤分期中是必不可少的,因此对于更多患者来说是正确的治疗方法。当然,它的准确性随着手术标本中检索到的节点数量的增加而增加,并且应该至少为12,这是由最后一个AJCC [17]确定的。在这项工作中,IMA的高位结扎政策始终尊重这一目标,包括腹腔镜和机器人组。在作者的研究中,机器人(中位数:14,范围:8到20)和腹腔镜(中位数:13,范围9到21)组中收获的淋巴结之间的差异不大; p值为0.498。相比之下,之前比较机器人和腹腔镜直肠癌手术的研究显示,收获的淋巴结数量没有显著差异[18-22]。作者研究中的8例患者在其最终手术标本中检出的淋巴结少于12个,其中机器人组有5个,另一个手臂有3个。值得注意的是,7例接受了新辅助化疗,其中2例已显示完全放射学反应,无残留肿瘤或硬结,但这两例中只有一例显示完全病理反应。
MRI前期化放疗后其他5例肿瘤反应评估显示部分消退。良好的肿瘤反应和收获的淋巴结数量少的巧合提高了更好的局部区域疾病控制的可能性,而不是手术或病理团队的尽职调查。不幸的是,少数案件是制定明确评论的障碍。
圆周径向边缘的质量连同远端边缘被认为是评估直肠癌治疗的主要参数。 目前工作的结果似乎确定了机器人手术优于腹腔镜手术的优势,如图6所示,能够在机器人组中充分剖析超出肿瘤下限(中位数:2.8,范围:1.4-4 cm)。 与腹腔镜组相比(中位数:1.8,范围:1-2.8)。 这在统计学上是明显的,p值小于0.001。 即使没有统计学意义,机器人组中超过85%的病例发生了完整的圆周径向边缘,即直肠筋膜完整性的发生,而腹腔镜组为62.5%(p值:0.079))。 Barnajian [23]和D'Annibale [24]以类似的方式报道了与腹腔镜系统相比,其机器人系列中更广泛的CRM。
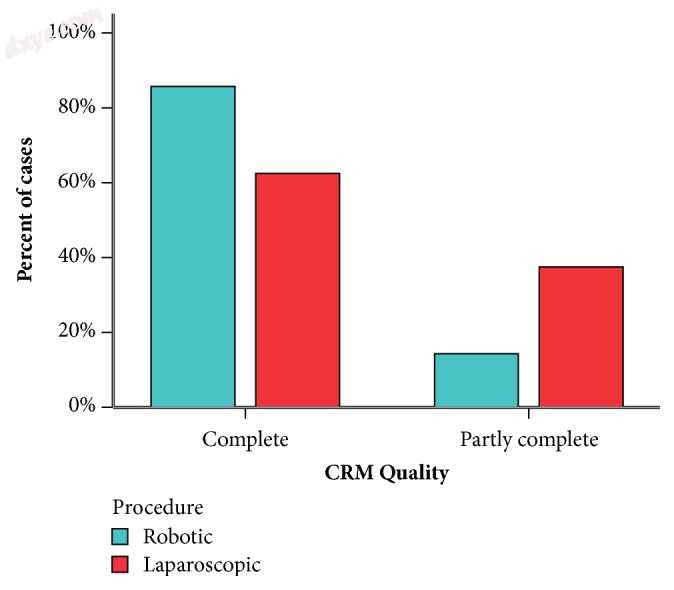
图6
CRM质量。
微创手术的主要好处之一是早期康复。在该试验期间,作者采用了增强的恢复方案,其中在术后第2天开始啜饮水(POD)0,在POD 1上开始液体饮食,在POD 2上开始软饮食。患者在鼓励独立和动员的环境中进行护理。强烈建议患者在术后第二天起床超过2小时。作者的出院标准包括没有心动过速的发热患者,口服喂养的耐受性,口服镇痛的充分控制疼痛,患者独立行走,非白化细胞计数或CRP,以及在家中的充分支持。尽管在临床上不明显,但在第一次肠胃支气管手术中支持腹腔镜组1.6天与机器人组中的2天相比有显著差异,p值:0.017。
该研究未显示两组在住院(LOS),并发症发生率,再次手术或再入院方面的显著差异。吻合口漏是结直肠手术中最严重的手术并发症。吻合口漏的认可风险因素是位于腹膜反射,受照射的骨盆,肥胖和术中输血的癌症[25,26]。在存在任何这些危险标准的情况下采用覆盖回肠造口术。在这项研究中,机器人和腹腔镜系列的整体吻合口漏率相似(4.8%对4.2%)。
机器人高清3D图像的辨别优势允许更好地识别自主神经。潜在的神经损伤部位是上腹下神经丛,导致男性射精功能障碍和女性润滑受损,骨盆内壁深处的盆腔内脏神经导致男性勃起功能障碍,腹腔镜组中一名患者发生4.2%与机器人组中的0%相比,在本研究中。作者采用一个简短的问卷来评估性功能,包括射精或勃起失败,以及后者的失败是完全还是部分,即难以穿透或维持勃起。作者只有一例抱怨部分勃起功能障碍。根据CLASSIC试验[27]的结果,与开放式方法相比,腹腔镜手术中男性性功能障碍的自主神经损伤风险显著更高。在同一背景下,两项研究表明机器人辅助直肠手术在预防性功能障碍或泌尿功能障碍方面优于传统的腹腔镜手术[26,28]。
值得一提的是,这项工作中最重要的优势点是通过置换块随机化,试图最小化选择偏差。
作者还要提到这项研究的弱点。首先,小样本量使作者无法得出正确的结论,特别是对于每种类型的程序。此外,除了一个月的短暂随访期外,本研究没有正确地关注功能结果。最后,外科医生在机器人和腹腔镜直肠手术之间的不同经验观点可能无法表明机器人平台的巨大技术特征。
8.结论
据作者所知,这是第一个在中东和北非地区进行机器人直肠手术的前瞻性随机试验。
作者的早期经验表明,机器人直肠手术是一种可行且安全的手术。在肿瘤学根治性和手术并发症方面,它不逊于标准腹腔镜检查。
这项针对45名患者的随机对照试验表明,机器人系统的远端边缘和CRM质量优于传统的腹腔镜检查,但手术时间较长的明显弱点。当然,需要更多样本量更大的随机试验来稳定直肠癌手术中的机器人方法。此外,目前的商用机器人平台最适合单象限限制解剖。因此,在直肠手术中存在一些局限性,其中涉及多于一个象限。相反,完美稳定的手术视野,手腕样功能,以及由第三机器人仪器产生的最佳方向和力可以改善这种微创技术在直肠癌治疗中的扩散。
最后,正如作者所认为的那样,这只是一个开始;很难想象未来的外科医生在没有界面的情况下工作。
缩略语
RCT:随机对照试验
BMI:体重指数
ASA:美国麻醉医师协会
CRM:周向径向边际
TME:全直肠系膜切除术
CRT:放化疗
MBO:恶性肠梗阻
IRB:机构审查委员会
NCI:国家癌症研究所
LOS:住院时间
IMA:肠系膜下动脉
CRP:C-反应蛋白
SPSS:社会科学统计软件包
LAR:低位前切除
APR:腹会阴切除术
DVT:深静脉血栓形成
POD:术后一天。
参考:
Robotic-Assisted versus Conventional Laparoscopic Approach for Rectal Cancer Surgery, First Egyptian Academic Center Experience, RCT
1. Jacobs M., Verdeja J. C., Goldstein H. S. Minimally invasive colon resection (laparoscopic colectomy) Surgical Laparoscopy Endoscopy. 1991;1:144–150. [PubMed]
2. Makin G. B., Breen D. J., Monson J. R. T. The impact of new technology on surgery for colorectal cancer. World Journal of Gastroenterology. 2001;7(5):612–621. doi: 10.3748/wjg.7.612. [PMC free article] [PubMed] [CrossRef]
3. Bonjer H. J., Deijen C. L., Abis G. A., et al. A randomized trial of laparoscopic versus open surgery for rectal cancer. The New England Journal of Medicine. 2015;372(14):1324–1332. doi: 10.1056/NEJMoa1414882. [PubMed] [CrossRef]
4. Adkins A., Albert M., Alsaleh D., et al. Low Anterior Resection/Proctectomy. In: Ross H., et al., editors. Robotic Approaches to Colorectal Surgery. Switzerland: Springer International Publishing; pp. 157–164.
5. Guillou P. J., Quirke P., Thorpe H., et al. Short-term endpoints of conventional versus laparoscopic-assisted surgery in patients with colorectal cancer (MRC CLASICC trial): multicentre, randomised controlled trial. The Lancet. 2005;365(9472):1718–1726. doi: 10.1016/s0140-6736(05)66545-2. [PubMed] [CrossRef]
6. van der Pas M. H., Haglind E., Cuesta M. A., et al. Laparoscopic versus open surgery for rectal cancer (COLOR II): short-term outcomes of a randomised, phase 3 trial. The Lancet Oncology. 2013;14(3):210–218. doi: 10.1016/S1470-2045(13)70016-0. [PubMed] [CrossRef]
7. Biondi A., Grosso G., Mistretta A., et al. Laparoscopic-assisted versusopen for colorectal cancer: short- and long-term outcomes comparison. Journal of Laparoendoscopic & Advanced Surgical Techniques. 2013;23:1–7. [PMC free article] [PubMed]
8. Vendramini D. L., Albuquerque M. M. D., Schmidt E. M., Rossi-Junior E. E., Gerent W. D. A., Cunha V. J. L. D. Laparoscopic and open colorectal resections for colorectal cancer. Arquivos brasileiros de cirurgia digestiva : ABCD = Brazilian archives of digestive surgery. 2012;25(2):81–87. doi: 10.1590/S0102-67202012000200004. [PubMed] [CrossRef]
9. Mirnezami A., Mirnezami R., Venkatasubramaniam A. K., Chandrakumaran K., Cecil T., Moran B. Robotic colorectal surgery: hype or new hope? A systematic review of robotics in colorectal surgery. Colorectal Disease. 2010 doi: 10.1111/j.1463-1318.2010.01999.x. [PubMed] [CrossRef]
10. Scarpinata R., Aly E. H. Does robotic rectal cancer surgery offer improved early postoperative outcomes? Diseases of the Colon & Rectum. 2013;56(2):253–262. doi: 10.1097/DCR.0b013e3182694595. [PubMed] [CrossRef]
11. Mak T. W., Lee J. F., Futaba K., Hon S. S., Ngo D. K., Ng S. S. Robotic surgery for rectal cancer: A systematic review of current practice. World Journal of Gastrointestinal Oncology. 2014;6(6):p. 184. doi: 10.4251/wjgo.v6.i6.184. [PMC free article] [PubMed] [CrossRef]
12. Ielpo B., Caruso R., Quijano Y., et al. Robotic versus laparoscopic rectal resection: Is there any real difference? A comparative single center study. The International Journal of Medical Robotics and Computer Assisted Surgery. 2014;10(3):300–305. doi: 10.1002/rcs.1583. [PubMed] [CrossRef]
13. Hance J., Rockall T., Darzi A. Robotics in Colorectal Surgery. Digestive Surgery. 2005;21(5-6):339–343. doi: 10.1159/000081350. [PubMed] [CrossRef]
14. Luca F., Valvo M., Ghezzi T. L., et al. Impact of robotic surgery on sexual and urinary functions after fully robotic nerve-sparing total mesorectal excision for rectal cancer. Annals of Surgery. 2013;257(4):672–678. doi: 10.1097/SLA.0b013e318269d03b. [PubMed] [CrossRef]
15. Allemann P., Duvoisin C., Di Mare L., Hübner M., Demartines N., Hahnloser D. Robotic-Assisted Surgery Improves the Quality of Total Mesorectal Excision for Rectal Cancer Compared to Laparoscopy: Results of a Case-Controlled Analysis. World Journal of Surgery. 2016;40(4):1010–1016. doi: 10.1007/s00268-015-3303-2. [PubMed] [CrossRef]
16. Lee S. H., Lim S., Kim J. H., Lee K. Y. Robotic versus conventional laparoscopic surgery for rectal cancer: Systematic review and meta-analysis. Annals of Surgical Treatment and Research. 2015;89(4):190–201. doi: 10.4174/astr.2015.89.4.190. [PMC free article] [PubMed] [CrossRef]
17. Edge SB., Byrd DR., Compton CC., Fritz AG., Greene FL., Trotti A. AJCC Cancer Staging Handbook. 7th. NewYork, NY: Springer-Verlag; 2010.
18. Bianchi P. P., Ceriani C., Locatelli A., et al. Robotic versus laparoscopic total mesorectal excision for rectal cancer: A comparative analysis of oncological safety and short-term outcomes. Surgical Endoscopy. 2010;24(11):2888–2894. doi: 10.1007/s00464-010-1134-7. [PubMed] [CrossRef]
19. Baek J.-H., Pastor C., Pigazzi A. Robotic and laparoscopic total mesorectal excision for rectal cancer: A case-matched study. Surgical Endoscopy. 2011;25(2):521–525. doi: 10.1007/s00464-010-1204-x. [PubMed] [CrossRef]
20. Baik S. H., Kwon H. Y., Kim J. S., et al. Robotic versus laparoscopic low anterior resection of rectal cancer: Short-term outcome of a prospective comparative study. Annals of Surgical Oncology. 2009;16(6):1480–1487. doi: 10.1245/s10434-009-0435-3. [PubMed] [CrossRef]
21. Kwak J. M., Kim S. H., Kim J., Son D. N., Baek S. J., Cho J. S. Robotic vs laparoscopic resection of rectal cancer: Short-term outcomes of a case-control study. Diseases of the Colon & Rectum. 2011;54(2):151–156. doi: 10.1007/DCR.0b013e3181fec4fd. [PubMed] [CrossRef]
22. Park J. S., Choi G.-S., Lim K. H., Jang Y. S., Jun S. H. Robotic-assisted versus laparoscopic surgery for low rectal cancer: Case-matched analysis of short-term outcomes. Annals of Surgical Oncology. 2010;17(12):3195–3202. doi: 10.1245/s10434-010-1162-5. [PubMed] [CrossRef]
23. Barnajian M., Pettet D., Kazi E., Foppa C., Bergamaschi R. Quality of total mesorectal excision and depth of circumferential resection margin in rectal cancer: A matched comparison of the first 20 robotic cases. Colorectal Disease. 2014;16(8):603–609. doi: 10.1111/codi.12634. [PubMed] [CrossRef]
24. D'Annibale A., Pernazza G., Monsellato I., et al. Total mesorectal excision: A comparison of oncological and functional outcomes between robotic and laparoscopic surgery for rectal cancer. Surgical Endoscopy. 2013;27(6):1887–1895. doi: 10.1007/s00464-012-2731-4. [PubMed] [CrossRef]
25. Liu Y., Wan X., Wang G., et al. A scoring system to predict the risk of anastomotic leakage after anterior resection for rectal cancer. Journal of Surgical Oncology. 2014;109(2):122–125. doi: 10.1002/jso.23467. [PubMed] [CrossRef]
26. Buchs N. C., Gervaz P., Secic M., Bucher P., Mugnier-Konrad B., Morel P. Incidence, consequences, and risk factors for anastomotic dehiscence after colorectal surgery: a prospective monocentric study. International Journal of Colorectal Disease. 2008;23(3):265–270. doi: 10.1007/s00384-007-0399-3. [PubMed] [CrossRef]
27. Broholm M., Pommergaard H.-C., Gögenür I. Possible benefits of robot-assisted rectal cancer surgery regarding urological and sexual dysfunction: A systematic review and meta-analysis. Colorectal Disease. 2015;17(5):375–381. doi: 10.1111/codi.12872. [PubMed] [CrossRef]
28. Nagtegaal I. D., van de Velde C. J. H., van der Worp E., Kapiteijn E., Quirke P., van Krieken J. H. J. M. Macroscopic evaluation of rectal cancer resection specimen: clinical significance of the pathologist in quality control. Journal of Clinical Oncology. 2002;20(7):1729–1734. doi: 10.1200/jco.2002.07.010. [PubMed] [CrossRef] |


