马上注册,结交更多好友,享用更多功能,让你轻松玩转社区。
您需要 登录 才可以下载或查看,没有账号?注册
×
概要
介绍:
随着肝硬化患者肝癌发病率的持续增加,保留肝实质的肝切除术越来越必要。描述了一种技术,其涉及使用由1英寸宽的包裹纱布制成的吊带来收回和旋转肝脏以分开右三角形和冠状韧带并操作7段。右叶片向前和逆时针旋转,允许进入和实质在超声波指导下横断第7段。
案例介绍:
第7节肿瘤患者中有7例采用上述技术进行切除:4例患儿为A级肝硬化和肝细胞癌(HCC),1例患有转移性结肠癌,1例患有腺瘤,1例患有症状性血管瘤。肿瘤大小介于2.5和7.7厘米之间。切除期间的失血量在150至500毫升之间。没有患者因手术需要输血。除1例难治性结肠炎患者外,平均住院时间为3.8天。
管理和成果:
保留薄壁组织的腹腔镜切除7段是可行的,并且可以使用吊带安全地进行用于体内肝脏收缩,操纵和定位。鉴于HCC复发的风险,腹腔镜肝切除术也可能更适合随后的挽救性肝移植,因为肝周粘连较少。
关键词:肝硬化,腹腔镜,肝癌,肝切除术,第7段
介绍
腹腔镜手术,术中超声,肝实质切除和血管吻合术的进展增加了腹腔镜肝切除术(LLR)的可行性.1,2 LLR与肝脏原发性和转移性癌症的开放式肝切除术相比具有优势。 3,4 LLR也被证明在肝硬化患者中具有可接受的安全性,并且在患者发生复发性不能手术的肝癌的情况下便于抢救肝移植。5,6 2009年,国际腹腔镜肝脏手术立场不支持切除术7段。7 然而,一些报道已经描述了LLR对肝脏后段肿瘤的可行性。对于7段中的肿瘤,6段通常作为后路切除术的一部分被包括在内。8,-10鉴于肝硬化患者中HCC的发病率增加,需要保留薄弱实质的技术以使术后肝功能不全最小化。作者描述了一种技术的前瞻性发展,该技术用于切除第7段中的肿瘤并保留第6段。
方法
患者用多相造影剂腹部成像(对比计算机断层扫描[CT]扫描和磁共振成像[MRI]与钆或Eovist; Bayer Schering Pharma,Berlin,Germany)进行评估。被认为可接受的手术候选者和生理学上可接受的手术同意的患者包括肝细胞瘤和儿童A级肝硬化,血小板计数大于100,000 / mm3的患者。使用Horos数字成像和医学通信(DICOM)观察器对所有患者进行手术计划。11 肿瘤呈现为体积并置于静脉内的三维(3D)最大投影强度(MIP)重建序列中阶段(图1)。检查肝后静脉腔静脉直径大于5 mm的短肝静脉并标记显示。在手术时,图像显示在手术室内的55英寸LED显示屏上。
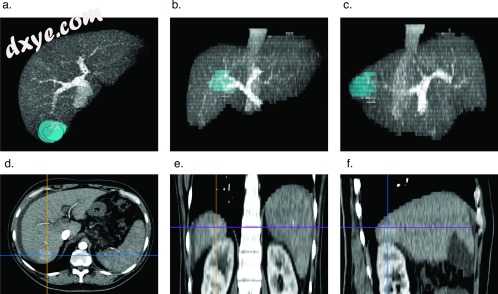
图1
肿瘤的3D MIP重建呈现为手术计划的体积。 肿瘤呈现为静脉期肝脏的重建3D MIP DICOM内的体积:轴向(A),冠状(B)和右矢状(C)视图。 用Horos开源医学图像阅读器读取DICOM 。11 轴向(D),冠状(E)和右矢状(F)动脉期图像是7段肝细胞瘤。
为了探索,使用Veress针放置一个5毫米的infraumbilical端口。 将5mm,30°腹腔镜置于腹部。 放置中上部12mm腹部端口用于腹腔镜肝脏超声检查。 放置两个右侧腹部(5和12mm)端口以剖开和操纵肝脏(图2)。 进行诊断性腹腔镜检查以排除癌症患者的肝外疾病。
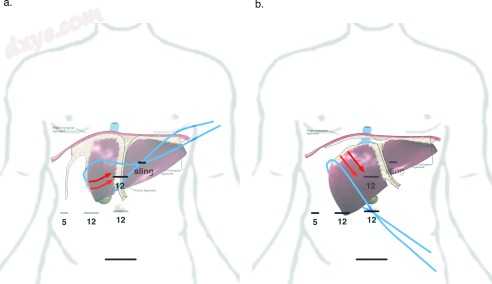
图2
端口和吊索放置暴露右三角韧带。 (A)蓝线代表吊索的位置和张力方向,以启动右三角韧带的暴露。红色箭头表示肝脏的预期旋转。 (B)滑过肝脏圆顶后的吊带。这种操作可以将肝脏从膈肌上拉开,从而可以进入背侧肝韧带并释放第7段.5和12毫米端口的位置显示为水平线。
将圆和镰状韧带分开,然后分开左右冠状韧带并分离裸露区域,直到右侧,中间和左侧肝静脉的前部可视化。使用“风扇”牵开器,将右三角韧带的下侧面暴露并分开,直到观察到腔静脉的右侧壁。将由1英寸包装带制成的吊带缠绕在段6周围,并通过左上腹部的3-4mm刺穿外部化(图2A)。将肝右叶轻轻向前拉,向左侧向头侧,进一步暴露右三角韧带。当右三角韧带被分开时,吊带向头部滑动。 8 一旦吊带超过8段,它就会重新定位并沿着脐中线端口的右侧外推,以使肝脏远离膈肌继续划分右三角韧带(图2B和图3)。
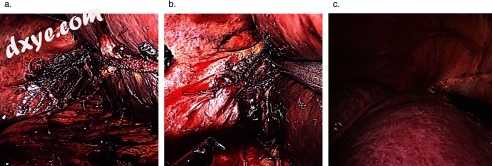
图3
使用吊带收回肝脏并露出右三角韧带。 (A)吊索暴露右三角韧带的后外侧面。 (B)后右上三角韧带的分裂。 (C)吊索将肝脏圆顶拉离横膈膜,向前和横向暴露右冠状韧带。注意右侧膈静脉排入腔静脉或右肝静脉。
然后将吊带重新定位回左上腹部并外化,并使肝脏向前旋转,暴露短肝静脉,将其双重夹住并在其间结扎。根据肝脏相对于胸壁的大小,如果没有足够的空间可以向前旋转右叶,则左三角韧带被分开,允许左侧部分在脾脏上滑动,为右侧旋转提供额外的空间肝前叶。为了完全释放7段,分割肝脏的背侧肝韧带。应该特别注意这一步骤,因为背侧肝韧带可能含有相当大的静脉并且靠近右肝静脉。背侧肝韧带的分裂暴露右肝静脉并允许肝右叶充分操作(图4A和44B)。此时注意不要过度用力,因为右肝静脉附近可能有额外的短肝静脉,这可能是搏动的。该方法也用于腹腔镜右肝叶切除术。
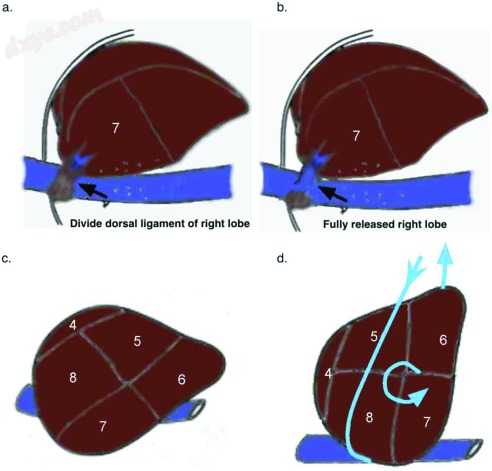
图4
背侧肝韧带的释放和肝脏的旋转。 (A)肝静脉分裂后肝脏韧带暴露后右肝操作。 (B)肝背韧带分裂后肝脏释放。 (C)肝脏的自然位置。 (D)使用缠绕在肝脏圆顶周围的1英寸包装旋转肝脏。
一旦完成右三角韧带和短肝静脉的充分分裂,将吊带定位在8段区上方,在5和6段区之间向后延伸,并通过左上腹刺伤口外化。吊索用于通过释放臂覆盖8段并在臂5和6后面拉动臂来旋转肝脏(图4C和4D)。
为了应用流入控制,将脐带缠绕在肝十二指肠韧带周围。为此,将一个肥胖的金色手指进入Winslow孔,脐带位于尖端。一旦穿过孔,将肝胃韧带分开,并用Maryland解剖钳抓住带。两端通过上部中线12毫米端口外部化,并通过10-French Rummel止血带送入。腹腔镜斗牛犬夹沿着硬塑料管上的带收紧(图5A和55B)。
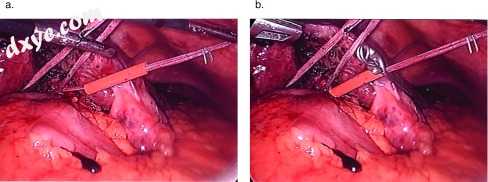
图5
使用带进行腹腔镜血流控制肝十二指肠韧带(Pringle手法)。 (A)肝十二指肠韧带周围的带。 (B)用bulldog钳夹住的肝十二指肠韧带收缩以限制流入肝脏。
使用超声引导,标记病变的边界,然后用氩束在肝脏表面上再以2cm的边缘标记。 开始流入阻塞,并且用Enseal,Harmonic Scalpel(均来自Ethicon,Summerville,New Jersey,USA)或最近的Cavitron超声手术吸气器(CUSA; Cavitron,York,Pennsylvania,USA)开始实质切除,具体取决于 通过超声波识别血管(图6)。

图6
旋转肝脏和组织横切肝癌。 (A)吊带用于旋转肝脏和下7段和前段。 在确定病变后使用谐波手术刀切除肝脏,并使用腹腔镜超声检查标记边界。 (B)肝切除平面。 (C)切除第7段的标本,然后通过切口取出。
结果
7名患者接受了腹腔镜7段切除术。 4例患者在良好代偿性肝硬化的情况下患有HCC。 表1显示了患者特征,肝脏状态,肿瘤类型以及右叶和胸腔的尺寸。 表2显示了手术细节,不良事件,住院时间和手术切缘。
表格1。
患者人口统计学,肿瘤病因学和维度
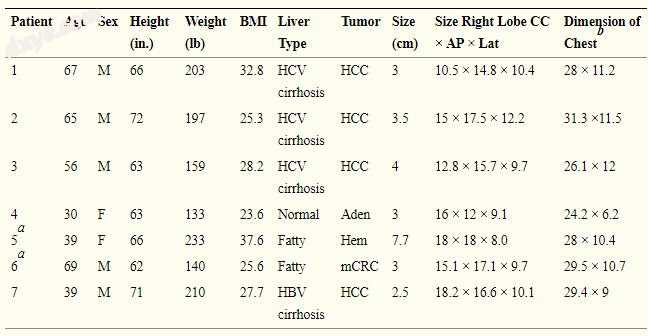
Aden,腺瘤; AP,前 - 后; CC,craniocaudad; Hem,血管瘤; Lat,从腔静脉到右侧胸壁; mCRC,转移性结直肠癌。
a由于旋转肝脏的空间有限,需要手部辅助手术。
b在门静脉分叉处和从胸骨后部到前主动脉的胸部间距。
表2
手术和术后活动
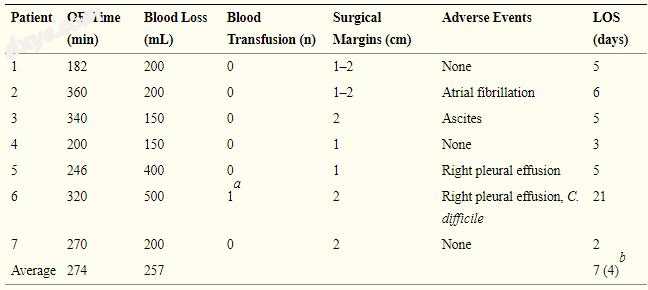
LOS, 住院天数; OR, 手术时间。
a开始血红蛋白水平9.2 g / dL;患者在病例开始时输血。
b(4)排除难治性结肠炎患者的LOS。
虽然患者样本太小而无法得出明确的结论,但在2例需要手助的患者中,患者5的体重指数为37.6,脂肪肝,7例患者的右叶最大切除。由于脂肪肝的脆弱性,吊带的使用在肝囊中引起了几次撕裂。为了减少大量失血的风险,使用手助腹腔镜检查。患者6在肝弯曲时对7cm结肠癌进行了右半结肠切除术。术前腹部CT扫描显示7段肿块与转移一致。普通外科医生打算在结肠手术时切除肝脏肿块,但意识到这是不可能的。获得了肝胆咨询。胸部的CT扫描结果为阴性,患者计划在7天后进行腹腔镜肝切除术。由于患者的小体框和粘连,使用手辅助技术。患者还患有术后难治性结肠炎,延长了住院时间。
手术前仅1例患者接受了输血;否则,不需要血液制品。手术时间从182分钟到360分钟不等。没有死亡。两名患者需要胸腔穿刺术治疗右侧胸腔积液。一名患有心房粘液瘤心脏直视手术病史的患者在术后第3天出现房颤。一名患者出现术后腹水并因利尿剂出院回家。除了患有难治性结肠炎的患者外,平均住院时间为3.8天。
在最后一次随访中,所有患者均存活,肝功能正常。患有治疗性丙型肝炎病毒(HCV)肝硬化的患者3在手术后18个月开发出新的2.2cm的左侧肝癌。
讨论
在肝硬化环境中肝癌发病率的增加具有术后肝功能障碍和衰竭的风险。保留肝实质是至关重要的,同时确保足够的手术切缘以实现R0切除。作者描述了一种系统的腹腔镜技术,用于操作和旋转肝右叶,提供进入节段7。通过使用腹腔镜超声检查,可以以足够的边缘识别,定位和安全切除肿瘤。
尽管7例患者中有4例在肝硬化的情况下接受了HCC切除术,但所有患者的操作技术相似。不需要肋间套管来划分右冠状动脉或三角韧带,因为吊带使肝脏能够从膈肌收回。这种回缩在暴露和分割背侧肝韧带时也很有用,这对于节段的释放至关重要。 7.应该注意的是,为了最好地观察和划分横向右三角和背侧肝韧带,需要将30°腹腔镜从中线无胸膜端口切换到右下侧12mm端口。此外,为了显示右三角韧带的上面,将30°腹腔镜从中线无胸膜端口切换到上中线12mm。
与先前的腹腔镜肝切除术一致,与该技术相关的最大变异性是在实质切除期间。使用流入控制和腹腔镜引导,肝硬化实质用Harmonic Sc​​alpel进行了令人满意的分割。对于脂肪肝,作者使用Enseal组织密封剂。对于正常或轻微纤维化的肝脏,作者使用腹腔镜CUSA和Enseal组织封闭剂。使用超声引导的腹腔镜吻合器对于脂肪肝是有用的,但是用肝硬化肝脏可以避免使用.2与铁砧容易穿过脂肪肝实质相反,肝硬化实质上通过砧进入肝脏有明显的阻力,以及关闭装订设备。例如,当无法通过烧灼,氩气束或加压烧灼控制实质出血时,使用小半圆(SH)针上的4英寸2.0丝线缝合线将八字形图形放入肝实质中。放置缝合线后,用腹腔镜针头驱动器轻轻拉动针头。一旦获得止血,将腹腔镜夹子放置在缝合线的针侧。这些缝合线应在病例开始时制作,在压缩前将丝缠绕在大血管夹的1个臂上(图7)。该技术已用于150多例腹腔镜肝切除术,无一例术后实质性出血。与大多数腹腔镜手术一样,在需要缝合缝线的情况下,具有立体光学可能特别有用。尽管已经描述了用于后段肿瘤的机器人肝脏切除,但是启动成本可能非常高。9 此外,考虑到需要将腹腔镜改为3个不同的端口,使用机器人可能证明是麻烦的。

图7
快速控制肝实质出血的缝合线构建。使用具有SH针的2.0丝线缝合线。通过将2.0缝合线缠绕在大血管夹的一个臂上来制造锚。然后压缩血管夹并固定锚。
根据需要重复使用15分钟的常规流入控制,然后进行5分钟的流入释放,直到实质切除完成。天冬氨酸氨基转移酶(AST)和丙氨酸氨基转移酶(ALT)水平的增加不超过正常上限的5倍并快速标准化。 2例右侧胸腔积液患者未发生肝硬化,但1例肝硬化患者出现术后腹水。所有3例HCV肝硬化患者在HCV治疗后均行切除术,手术时和6个月后未检出病毒。患者3在手术后18个月开发出新的肝细胞瘤。鉴于他年龄小,利尿依赖性和HCC是他的第二个,他正在接受局部治疗和抢救肝移植的评估。尽管HCC在技术上是可切除的,但进一步的肝脏手术可能会增加肝移植的风险
总之,在7段中腹腔镜切除肿瘤是可行和安全的。本报告提供了详细的技术说明,作者希望能够扩大其使用范围并获得可接受的可重复结果。
参考:
A Sling Technique for Laparoscopic Resection of Segment Seven of the Liver
1. Cuesta MA, Meijer S, Borgstein PJ, Sibinga Mulder L, Sikkenk AC. Laparoscopic ultrasonography for hepatobiliary and pancreatic malignancy. Br J Surg. 80:1993;1571–1574. [PubMed]
2. Gumbs AA, Gayet B, Gagner M. Laparoscopic liver resection: when to use the laparoscopic stapler device. HPB (Oxford) 2008;10:296–303. [PMC free article] [PubMed]
3. Zhou YM, Shao WY, Zhao YF, Xu DH, Li B. Meta-analysis of laparoscopic versus open resection for hepatocellular carcinoma. Dig Dis Sci. 2011;56:1937–1943. [PubMed]
4. Langella S, Russolillo N, D'Eletto M, Forchino F, Lo Tesoriere R, Ferrero A. Oncological safety of ultrasound-guided laparoscopic liver resection for colorectal metastases: a case-control study. Updates Surg. 2015;67:147–155. [PubMed]
5. Memeo R, de'Angelis N, Compagnon P, et al. Laparoscopic vs. open liver resection for hepatocellular carcinoma of cirrhotic liver: a case-control study. World J Surg. 2014;38:2919–2926. [PubMed]
6. Laurent A, Tayar C, Andréoletti M, Lauzet JY, Merle JC, Cherqui D. Laparoscopic liver resection facilitates salvage liver transplantation for hepatocellular carcinoma. J Hepatobiliary Pancreat Surg. 2009;16:310–314. [PubMed]
7. Buell JF, Cherqui D, Geller DA, et al. The international position on laparoscopic liver surgery: The Louisville Statement, 2008. Ann Surg. 2009;250:825–830. [PubMed]
8. Coles SR, Besselink MG, Serin KR, et al. Total laparoscopic management of lesions involving liver segment 7. Surg Endosc. 2015;29:3190–3195. [PubMed]
9. Boggi U, Caniglia F, Vistoli F, Costa F, Pieroni E, Perrone VG. Laparoscopic robot-assisted resection of tumors located in posterosuperior liver segments. Updates Surg. 2015;67:177–183. [PubMed]
10. Casaccia M, Andorno E, DiDomenico S, et al. Laparoscopic right posterior sectionectomy for hepatocellular carcinoma using a modified liver-hanging maneuver. J Laparoendosc Adv Surg Tech A. 2012;22:488–491. [PubMed]
11. Horos DICOM Medical Image Viewer v. 2.2.0 (2017). Available at https://horosproject.org.
12. Lee W, Han HS, Yoon YS, Cho JY, Choi Y, Shin HK. Role of intercostal trocars on laparoscopic liver resection for tumors in segments 7 and 8. J Hepatobiliary Pancreat Sci. 2014;21:E65–E684. [PubMed] |


