马上注册,结交更多好友,享用更多功能,让你轻松玩转社区。
您需要 登录 才可以下载或查看,没有账号?注册
×
概要
最近开发了内窥镜全层切除术结合腹腔镜手术。这些程序可分为“首先切割然后缝合”和“首先缝合然后切割”。 “首先切割然后缝合”包括腹腔镜和内窥镜协同手术(LECS)和腹腔镜辅助内窥镜全层切除术(LAEFR)。最近的研究证明了LECS和LAEFR的安全性和有效性。然而,这些技术受到肿瘤和胃粘膜与腹膜腔的相关暴露和这些器官的操纵的限制,这可能导致活细胞癌细胞接种和胃液溢出进入腹膜腔。在“首先缝合然后切割”技术中,缝合胃的浆膜侧以使胃翻转,随后进行内窥镜切除。在本文中,描述了这些技术的细节,包括它们的优点和局限性。
关键词:内镜全层切除术,腹腔镜与内镜下联合手术,非暴露内镜下壁内翻术,非暴露简易缝合内镜全层切除术
介绍
术中内窥镜检查(在腹腔镜或开放手术期间进行内窥镜检查)最常用于识别肿瘤边缘或检测吻合部位出血。术中内镜切除术也正在开发中。由于最小组织切除是术中内镜切除的主要目的,通常采用腹腔镜手术而不是开放手术。用于早期胃癌(EGC)的内窥镜粘膜下剥离术(ESD)通常不需要腹腔镜手术。小腹部肿瘤的内镜全层切除术(EFTR)也可在不进行腹腔镜检查的情况下进行[1-3]。然而,大多数肿瘤的EFTR通常需要腹腔镜检查,这样可以缝合切除部位并控制外肠壁的出血[4]。结合EFTR和腹腔镜方法可以称为混合自然孔口经腔内窥镜手术(NOTES)。 NOTES是一种微创手术,通过自然孔口(如口腔或肛门)进入腹膜或胸腔。由于标准NOTES技术的技术限制,NOTES技术可以结合经皮硬性腹腔镜方法,这被称为混合NOTES技术[4]。
腹腔镜手术的EFTR技术包括腹腔镜和内镜下合作手术(LECS),腹腔镜辅助内镜全层切除术(LAEFR),非暴露内镜下壁内翻术(NEWS)和非暴露简易缝合内窥镜全层切除术切除术(NESS-EFTR)。这些技术被分类为“首先切割然后缝合”和“首先缝合然后切割”。这里,描述了这些技术的优点和局限性。
首先切割,然后缝合
Hiki等。首先报道了2008年LECS的使用[5]。在该过程中,内窥镜医师进行周围粘膜下切口,然后使用针刀在胃壁上穿孔。在腹膜上腹腔镜进行血管肌切除和开口闭合。在内窥镜切除之前,使用腹腔镜超声激活装置移除预期切除区域上的血管。作为内窥镜介入的第一步,使用氩等离子体凝固标记肿瘤的侧边缘。如在ESD技术中那样执行标记区域外的内窥镜周围粘膜切口。使用针刀沿着粘膜下层的开口(周围粘膜切口的切口线)产生人工穿孔。此后,执行腹腔镜手术。在血清肌肉解剖开始时,将超声激活装置的尖端插入穿孔中。切除肿瘤周长的二至三分之四后,将肿瘤翻转至腹膜腔。通过腹腔镜辅助装置提升肿瘤,并使用腹腔镜吻合器切除并缝合肿瘤[5]。
LECS相对于传统腹腔镜楔形切除的益处是在切除期间直接内窥镜腔内可视化肿瘤。腹腔镜楔形切除术用于外周肿瘤通常被认为是一种简单的手术。然而,在腹腔镜切除腔内生长肿瘤期间可能发生胃组织的过度切除。过度的胃切除可能导致胃的术后畸形,从而引起胃淤滞。直接内窥镜可视化和肿瘤周围切口可导致胃组织的最小切除。
Abe等。还报道了2008年一种名为LAEFR的类似手术,其中内镜检查的作用增加[6]。在LECS和LAEFR中,在内窥镜壁穿孔后围绕肿瘤周围的内窥镜粘膜下切口是相同的。此后,进行粘膜下切口线周长的四分之三左右的内窥镜全厚度切割。最后,腹腔镜进行血清肌肉切开和缝合。
LECS和LAEFR结果总结在表1 [5-13]中。 最近的一项最大的回顾性研究表明,LECS是安全有效的[13]。 这项回顾性研究纳入了100名接受LECS治疗上皮下肿瘤(SETs)的患者。 在所有病例中均实现了具有阴性手术切缘的完全切除,包括在胃贲门处的9个肿瘤。 平均手术时间为174分钟,估计失血量最小(16 mL)。 口服摄入开始前的平均时间为1.4天。 唯一严重的不良事件是泄漏,发生在一名患者身上。 没有观察到局部或远处肿瘤复发的病例。 在日本,这种技术得到了健康保险的批准和保护[13]。
表格1。
腹腔镜和内窥镜合作手术和腹腔镜辅助内镜全厚度切除术的研究
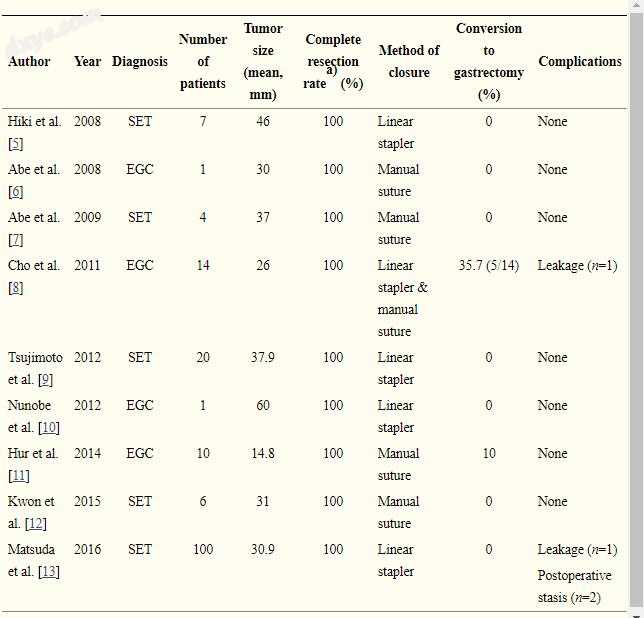
SET,上皮下肿瘤; EGC,早期胃癌。
a)整块切除和明确切除边缘。
到目前为止,LECS和LAEFR研究主要集中在SET的切除上。由于淋巴结转移的风险,用LECS或LAEFR治疗EGC的报道并不常见。 Cho等人。报道了14例经前哨淋巴结导航后用LAEFR治疗的EGC [8]。所有病例均切除,切除边缘为阴性,但需要转为5例胃大部切除术。转为胃切除术的原因是重建问题(扭曲或沙漏形状),吻合后血管流动不足和渗漏。肿瘤中位数为26 mm(范围12-90 mm),中位手术时间为143分钟(范围110-253分钟)。成功病例的估计失血量为16 mL(范围,5-30 mL)。目前,一项评估EGC(SENORITA试验)前哨淋巴结导航的随机对照前瞻性试验正在进行中[14]。如果SENORITA试验证明EGC的前哨淋巴结导航的安全性和有效性,将进行进一步的EFTR研究以评估EFTR对EGC的有效性。
缝合第一次然后切割
外科手术以及LECS和LAEFR通常涉及切除,然后缝合。 “首先切割然后缝合”方法的局限性在于肿瘤和胃粘膜暴露于腹膜腔内并在其内操作。很难完全避免将活肿瘤细胞接种到腹膜腔中。因此,没有溃疡的SET被认为是LECS的指征[5]。由胃液溢出进入腹腔引起的可能的感染或炎症是另一个问题。 “首先缝合然后切割”,开发了技术来克服这种限制。 “首先缝合然后切割”意味着首先从腹膜腔腹腔镜缝合胃壁,导致胃壁翻转。然后进行内窥镜切除。通过口腔取出肿瘤组织,意味着肿瘤不暴露于腹膜(非暴露技术)。
NEWS是第一个“先缝后切”技术[15]。在NEWS中,在标记放置在粘膜和浆膜侧之后,通过腹腔镜进行圆周血管肌切口,并且通过内窥镜形成圆周粘膜下液体垫。随后,将血管肌层线性缝合,将病变倒置到腔内侧,并将手术海绵放置在倒置病变的缝合和浆膜平面之间的空间中。最终内窥镜切除病灶[16,17]。 6名SET患者的初步报告和20名SET患者的随后报告显示成功结果。所有患者均可进行全层切除,边缘清晰。没有发生严重的术中或术后不良事件。在初始研究中,33%(2/6)的患者出现穿孔,但在后来的报告中这一比例提高到5%[15,17]。该技术的局限性在于它需要困难的手术,例如腹腔镜圆周肌肉切口,手术海绵插入和沿着切口部位的腹腔镜肌肉缝合。由于空间狭窄和可视化有限,腹腔镜体内缝合和吻合术被认为是腹腔镜手术中最困难和最耗时的任务[18]。
Kim等人。提出了类似的NESS技术,跳过腹腔镜圆周血管肌肉切口(NESS-EFTR)[19]。使用带倒钩的缝合线缝合浆膜侧(血管肌层),而不是使用圆周的血管肌切口,然后沿着切口线缝合并打结。粘膜侧,带有内圈和夹子。带倒钩的缝合线消除了打结的需要,节省了手术时间,并简化了手术过程。添加内窥镜粘膜缝合线以提供安全的吻合。到目前为止,只有动物研究已经发表,但临床试验(NCT02764944和NCT03216174)正在进行中。
腹腔镜和内镜下结合非肿瘤技术(CLEAN-NET)的方法被提出作为非暴露技术[20]。在CLEAN-NET中,内窥镜检查用于识别肿瘤边缘,但不进行内窥镜切除。切除和缝合是通过腹腔镜进行的。因此,本文不讨论其细节。
结论
内窥镜检查结合腹腔镜手术的内镜检查的初步作用是内窥镜穿孔。 随后的研究已经实现EFTR和内窥镜缝合,其通过腹腔镜检查相结合。 内窥镜检查的作用将增加,以实现微创手术。
参考:
Endoscopic Full-Thickness Resection Combined with Laparoscopic Surgery
1. Schlag C, Wilhelm D, von Delius S, Feussner H, Meining A. EndoResect study: endoscopic full-thickness resection of gastric subepithelial tumors. Endoscopy. 2013;45:4–11. [PubMed]
2. Shi Q, Chen T, Zhong YS, et al. Complete closure of large gastric defects after endoscopic full-thickness resection, using endoloop and metallic clip interrupted suture. Endoscopy. 2013;45:329–334. [PubMed]
3. Zhou PH, Yao LQ, Qin XY, et al. Endoscopic full-thickness resection without laparoscopic assistance for gastric submucosal tumors originated from the muscularis propria. Surg Endosc. 2011;25:2926–2931. [PubMed]
4. Kim CG. Natural orifice transluminal endoscopic surgery and upper gastrointestinal tract. J Gastric Cancer. 2013;13:199–206. [PMC free article] [PubMed]
5. Hiki N, Yamamoto Y, Fukunaga T, et al. Laparoscopic and endoscopic cooperative surgery for gastrointestinal stromal tumor dissection. Surg Endosc. 2008;22:1729–1735. [PubMed]
6. Abe N, Mori T, Takeuchi H, et al. Successful treatment of early stage gastric cancer by laparoscopy-assisted endoscopic full-thickness resection with lymphadenectomy. Gastrointest Endosc. 2008;68:1220–1224. [PubMed]
7. Abe N, Takeuchi H, Yanagida O, et al. Endoscopic full-thickness resection with laparoscopic assistance as hybrid NOTES for gastric submucosal tumor. Surg Endosc. 2009;23:1908–1913. [PubMed]
8. Cho WY, Kim YJ, Cho JY, et al. Hybrid natural orifice transluminal endoscopic surgery: endoscopic full-thickness resection of early gastric cancer and laparoscopic regional lymph node dissection--14 human cases. Endoscopy. 2011;43:134–139. [PubMed]
9. Tsujimoto H, Yaguchi Y, Kumano I, Takahata R, Ono S, Hase K. Successful gastric submucosal tumor resection using laparoscopic and endoscopic cooperative surgery. World J Surg. 2012;36:327–330. [PubMed]
10. Nunobe S, Hiki N, Gotoda T, et al. Successful application of laparoscopic and endoscopic cooperative surgery (LECS) for a lateral-spreading mucosal gastric cancer. Gastric Cancer. 2012;15:338–342. [PubMed]
11. Hur H, Lim SG, Byun C, et al. Laparoscopy-assisted endoscopic full-thickness resection with basin lymphadenectomy based on sentinel lymph nodes for early gastric cancer. J Am Coll Surg. 2014;219:e29–e37. [PubMed]
12. Kwon OK, Yu W. Endoscopic and laparoscopic full-thickness resection of endophytic gastric submucosal tumors very close to the esophagogastric junction. J Gastric Cancer. 2015;15:278–285. [PMC free article] [PubMed]
13. Matsuda T, Hiki N, Nunobe S, et al. Feasibility of laparoscopic and endoscopic cooperative surgery for gastric submucosal tumors (with video) Gastrointest Endosc. 2016;84:47–52. [PubMed]
14. Park JY, Kim YW, Ryu KW, et al. Assessment of laparoscopic stomach preserving surgery with sentinel basin dissection versus standard gastrectomy with lymphadenectomy in early gastric cancer-a multicenter randomized phase III clinical trial (SENORITA trial) protocol. BMC Cancer. 2016;16:340. [PMC free article] [PubMed]
15. Mitsui T, Niimi K, Yamashita H, et al. Non-exposed endoscopic wall-inversion surgery as a novel partial gastrectomy technique. Gastric Cancer. 2014;17:594–599. [PMC free article] [PubMed]
16. Goto O, Mitsui T, Fujishiro M, et al. New method of endoscopic full-thickness resection: a pilot study of non-exposed endoscopic wall-inversion surgery in an ex vivo porcine model. Gastric Cancer. 2011;14:183–187. [PubMed]
17. Goto O, Takeuchi H, Sasaki M, et al. Laparoscopy-assisted endoscopic full-thickness resection of gastric subepithelial tumors using a nonexposure technique. Endoscopy. 2016;48:1010–1015. [PubMed]
18. Milone M, Di Minno MN, Galloro G, et al. Safety and efficacy of barbed suture for gastrointestinal suture: a prospective and randomized study on obese patients undergoing gastric bypass. J Laparoendosc Adv Surg Tech A. 2013;23:756–759. [PubMed]
19. Kim CG, Yoon HM, Lee JY, et al. Nonexposure endolaparoscopic full-thickness resection with simple suturing technique. Endoscopy. 2015;47:1171–1174. [PubMed]
20. Inoue H, Ikeda H, Hosoya T, et al. Endoscopic mucosal resection, endoscopic submucosal dissection, and beyond: full-layer resection for gastric cancer with nonexposure technique (CLEAN-NET) Surg Oncol Clin N Am. 2012;21:129–140. [PubMed] |


