马上注册,结交更多好友,享用更多功能,让你轻松玩转社区。
您需要 登录 才可以下载或查看,没有账号?注册
×
概要
背景
本研究的目的是比较注射不同浓度的肉毒杆菌毒素-A(BTX-A)后大鼠咬肌中p65和S100的表达水平。
方法
作者将5或10U的BTX-A注射到大鼠的两个咬肌中。作为对照组,注射相同体积的盐水。 14天后,处死动物。随后,使用p65或S100抗体进行样品的活组织检查和免疫组织化学染色。
结果
通过BTX-A注射显著降低每个肌原纤维的横截面积(P <0.001)。随着BTX-A浓度的增加,p65和S100的表达显著增加(P <0.001)。
结论
将BTX-A注射到咬肌中诱导肌肉萎缩。随后,增加成肌细胞中p65和S100的表达以保护肌细胞。
关键词:肉毒毒素A,p65,S100,细胞凋亡,咬肌
背景
肉毒杆菌毒素是由厌氧菌肉毒梭菌产生的神经毒素[1,2]。该毒素选择性地水解突触小泡和神经肌肉接头突触前膜结合所需的受体;结果,毒素阻断了乙酰胆碱[3-6]的释放,导致肌肉无力,瘫痪和萎缩[7]。肉毒杆菌毒素-A(BTX-A)是一种肉毒杆菌毒素,于1989年获得美国食品和药物管理局(FDA)批准。从那时起,BTX-A已用于美容,局灶性肌张力障碍,面部痉挛,多汗症,以及肌肉肥厚性疾病的治疗[8,9]。
此外,在口腔和颌面部区域,为了美学和治疗目的,将BTX-A注入咀嚼肌,例如咬肌或颞肌[10-12]。以前的研究主要研究了BTX-A对肌肉和神经的影响[13]。然而,即使将BTX-A注射到肌肉中,肌肉麻痹或虚弱也会对骨骼造成影响,导致受影响的骨骼减少[14,15]。因此,需要更多的研究来解释BTX-A影响咬肌的机制。
注射到咬肌中的BTX-A诱导肌肉萎缩[16]。几种标记蛋白在骨骼肌萎缩过程中有可能增加其表达[17]。 S100是众所周知的钙结合蛋白[18,19]。在许多出版物中,末端脱氧核苷酸转移酶dUTP缺口末端标记(TUNEL)测定已用于评估细胞凋亡[20]。烧伤后,肌肉萎缩伴随着运动神经中S100水平和TUNEL阳性细胞的增加[21]。 NF-κB途径在细胞凋亡中很重要。在骨骼肌萎缩期间,caspase和NF-kB通路关键组分(p65)的表达增加[22]。因此,在BTX-A注射后,咬肌中S100和p65的表达水平可能会改变。然而,之前在BTX-A注射的背景下尚未研究S100表达水平。
本研究的目的是比较注射不同浓度的BTX-A后大鼠咬肌中p65和S100的表达水平。
方法
实验动物和住房条件
从Samtako(Osan,Korea)购买15只Sprague-Dawley大鼠(10-12周龄,体重250-300g)。每只大鼠单独饲养并允许适应期10天。江陵原州国立大学的机构动物护理和使用委员会批准了这个实验(GWNU 2015-25)。
实验设计
将动物分成三组:对照组和两个实验组。每组使用5只大鼠。在一个实验组中,将5U的BTX-A溶液注射到咬肌的两侧。在另一个实验组中,将10U的BTX-A溶液注射到咬肌的两侧。对照组在咬肌两侧注射0.1cc生理盐水。注射后14天,处死所有大鼠,获得含有咬肌和下颌骨的样品用于组织学检查。将收获的组织在福尔马林溶液中固定1天后,用5%硝酸溶液进行脱钙,产生含有咬肌和下颌骨的标本。为了以下评估,将样品切割成水平面。切割支的高度被确定为颧弓平面和下颌下缘平面之间的中心切口。
用苏木精和伊红(H&E)染色标本以评估下颌支的皮质骨厚度。作者在手术后14天拍摄组织学视图,并使用尺寸测量软件(SigmaScan-Pro®; SPSS Science,Chicago,IL,USA)测量大鼠的皮质骨厚度。还使用相同的软件测量肌原纤维的横截面积。对p65和S100进行免疫组织化学染色。两种抗体都是购自Santa Cruz Biotech(Santa Cruz,CA,USA)的鼠单克隆抗体。一抗稀释如下:S100,1:30;和p65,1:50。后续程序符合先前的出版物[23]。
为了量化免疫组织化学反应的强度,使用计算机辅助图像分析程序在×200放大倍数下在咬肌的五个随机视野中评估阳性染色的强度。免疫组织化学实验中的染色强度显示为平均强度值(0:无染色,255:最高染色)。省略了对应程序以确保强度值仅归因于阳性免疫组织化学反应。
统计分析
使用单因素方差分析(ANOVA)对所有结果进行统计学分析,然后进行事后检验(Bonferroni方法)。 显著性水平设定为P <0.05。
结果
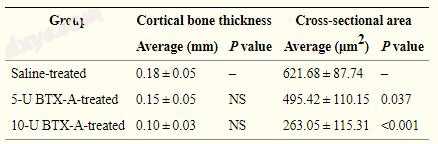
下颌支的水平切口如图1a-c所示,分别用于盐水处理的5-U BTX-A处理和10-U BTX-A处理的样品。 皮质骨的平均厚度测量如下:盐水处理的对照组的厚度为0.18±0.05mm,5-U BTX-A处理的组的厚度为0.15±0.05mm,10- U BTX-A处理组的厚度为0.10±0.03mm(表1)。 与盐水处理的对照组相比,BTX-A处理组的大鼠下颌支的皮质骨厚度减少。 然而,各组间观察到的差异无统计学意义(P = 0.055)。
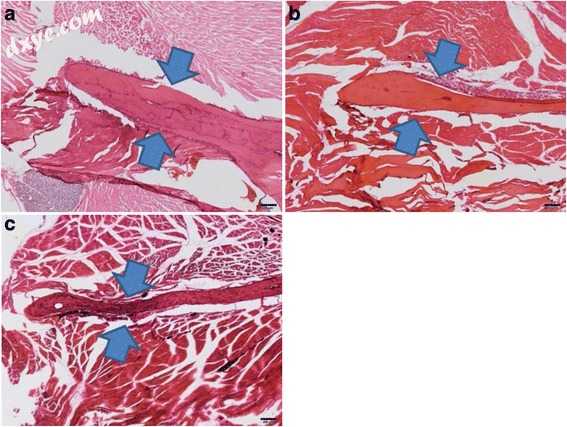
图.1
大鼠下颌支的皮质骨。 箭头表示下颌支。 盐水治疗组; b 5-U BTX-A处理组; c 10-U BTX-A处理组(H&E染色,原始放大倍数×20)
表格1
BTX-A注射后皮质骨厚度和咬肌的横截面积
通过事后测试计算P值并与盐水处理组比较
BTX-A肉毒杆菌毒素-A
咬肌的横截面显示在图2a-c中,分别用于盐水处理的5-U BTX-A处理的和10-U BTX-A处理的样品。对于盐水处理对照组,5-U BTX-A处理组和10-U BTX-A,肌原纤维的平均横截面积为621.68±87.74μm2,495.42±110.15μm2和263.05±115.31μm2。 - 处理组,分别(表1)。与盐水处理的对照组相比,在BTX-A处理组中肌原纤维的横截面积显著降低(P <0.001)。事后测试揭示了用10U BTX-A和其他组治疗的组之间的差异,10-U BTX-A组中的值显著低于盐水处理对照组和5-U BTX-A-中的值。治疗组(两组P <0.001)。当作者将5-U BTX-A处理组与盐水处理对照组进行比较时,观察到的差异具有统计学意义(P = 0.037)。
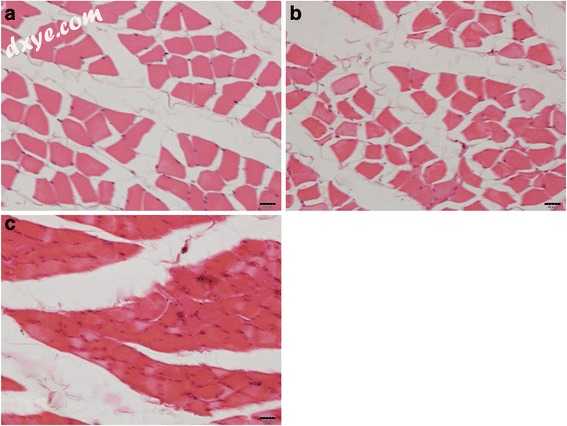
图2
咬肌的横截面。盐水治疗组; b 5-U BTX-A处理组; c 10-U BTX-A处理组(H&E染色,条形=20μm)
p65和S100的免疫组织化学结果显示在图4和5中。 3和4.4。免疫组织化学结果表明,在10-U BTX-A处理组中p65和S100的表达显著高于生理盐水组(图3d和4d; 4d; P <0.001和P = 0.002对于p65和分别为S100)。对于盐水,5-U BTX-A和10-U BTX-A处理,p65的平均强度值分别为81.02±1.53,82.93±2.11和106.46±10.86。事后测试揭示了用10U BTX-A和其他组治疗的组之间的差异,10-U BTX-A组中的值显著高于盐水处理对照组和5-U BTX-A组。 - 治疗组(两组P <0.001)。对于盐水,5-U BTX和10-U BTX处理,S100的平均强度值分别为78.98±4.36,85.31±3.09和96.46±8.98。事后测试揭示了用10U BTX-A和其他组治疗的组之间的差异,10-U BTX-A组中的值显著高于盐水处理对照组和5-U BTX-A-中的值。治疗组(分别为盐水和5-U BTX-A治疗组的P = 0.002和P = 0.038)。
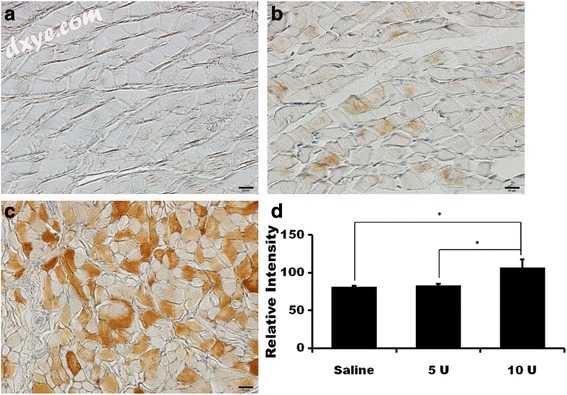
图3
p65的免疫组织化学染色。 盐水治疗组; b 5-U BTX-A处理组; c 10-U BTX-A处理组(无复染,bar =20μm)。 d染色平均强度的测量(* P <0.05)
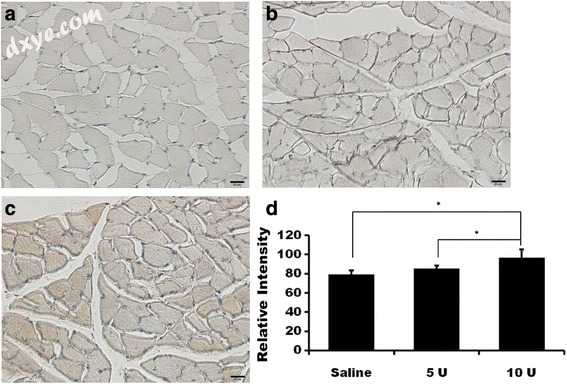
图4
S100的免疫组织化学染色。盐水治疗组; b 5-U BTX-A处理组; c 10-U BTX-A处理组(无复染,bar =20μm)。 d染色平均强度的测量(* P <0.05)
讨论
BTX-A已用于各种口腔和颌面应用。 BTX-A主要注入咀嚼肌,如咬肌或颞肌,用于颌面部的美学和治疗目的[3,6]。据报道,有少数研究调查了BTX对咀嚼肌的影响[7,17]。然而,之前未报道BTX-A注射后咬肌中的短期分子水平变化。在该研究中,在BTX-A注射后14天,p65和S100在大鼠咬肌中以剂量依赖性方式增加(图3和4).4)。当肌肉发生萎缩性变化时(图2),BTX-A注射后14天皮质骨的厚度减少(图1)。据作者所知,这是BTX-A注射后咬肌中剂量依赖性早期变化的第一份报告。
在该研究中,与盐水处理的对照相比,BTX-A注射后14天下颌支的皮质骨厚度减少(图1)。然而,各组之间观察到的差异无统计学意义(图1d,P> 0.05)。先前的出版物表明在BTX-A注射后4周和8周时骨厚度存在显著差异[24]。缺乏重要性可能是由于样本量小和随访时间短。 BTX注射组中下颌支的较薄皮质可能与咬肌萎缩继发的废用性萎缩相似。许多先前的研究报告说,如果骨骼没有受到肌肉的持续刺激,骨骼就会萎缩[8,14]。当患有骨质疏松症的患者接受BTX-A注射时,应仔细监测BTX-A的最佳剂量。 BTX-A注射可以立即减少咬肌中的肌电信号[5]。在该研究中,与注射盐水的对照相比,注射BTX-A的肌丝表现出减小的尺寸(图2)。
通常,肌肉萎缩是由导致肌肉萎缩的全身性疾病引起的。在这项研究中,BTX-A注射减少了肌原纤维的大小;这种变化应该被解释为肌肉萎缩(图2)。在细胞因子诱导的肌管萎缩过程中,NF-kB(p65)的一个成分被激活[25]。此外,血清S100通过刺激活性氧诱导成肌细胞凋亡[26]。在该研究中,与盐水处理的对照相比,注射BTX-A组中NF-κB和S100的表达增加。当细胞凋亡发生时,NF-kB的表达增加[14,27]。当组织中的钙浓度增加时,S100的表达也增加[28,29]。观察到的p65和S100的增加可能是由BTX-A注射后的肌肉萎缩或凋亡应激引起的。当肌肉细胞凋亡发生时,细胞内钙离子可能会释放到细胞外空间[30]。由于S100是钙结合蛋白,增加的钙释放可以增加S100的表达。然而,S100可以预防成肌细胞凋亡[31]。因此,由于在BTX-A注射后保护成肌细胞免于凋亡,可能发生S100的增加的表达。 BTX-A诱导的成肌细胞凋亡也在最近的出版物中得到证实[32]。
结论
在这项研究中,将BTX-A注射到咬肌中诱发肌肉萎缩。随后,增加成肌细胞中p65和S100的表达以保护肌细胞。
参考:
S100 and p65 expression are increased in the masseter muscle after botulinum toxin-A injection
1. Burgen A, Dickens F, Zatman L. The action of botulinum toxin on the neuro-muscular junction. J Physiol. 1949;109:10–23. doi: 10.1113/jphysiol.1949.sp004364. [PMC free article] [PubMed] [CrossRef]
2. Schiavo G, Benfenati F, Poulain B, Rossetto O, Polverino de Laureto P, DasGupta BR, et al. Tetanus and botulinum-B neurotoxins block neurotransmitter release by proteolytic cleavage of synaptobrevin. Nature. 1992;359:832–835. doi: 10.1038/359832a0. [PubMed] [CrossRef]
3. Su JZ, Cai ZG, Yu GY. Microvascular autologous submandibular gland transplantation in severe cases of keratoconjunctivitis sicca. Maxillofac Plast Reconstr Surg. 2015;37:5. doi: 10.1186/s40902-015-0006-4. [PMC free article] [PubMed] [CrossRef]
4. Navarrete AL, Rafferty KL, Liu ZJ, Ye W, Greenlee GM, Herring SW. Botulinum neurotoxin type A in the masseter muscle: effects on incisor eruption in rabbits. Am J Orthod Dentofacial Orthop. 2013;143:499–506. doi: 10.1016/j.ajodo.2012.10.023. [PMC free article] [PubMed] [CrossRef]
5. Park SY, Park YW, Ji YJ, Park SW, Kim SG. Effects of a botulinum toxin type A injection on the masseter muscle: an animal model study. Maxillofac Plast Reconstr Surg. 2015;37:10. doi: 10.1186/s40902-015-0010-8. [PMC free article] [PubMed] [CrossRef]
6. Seok H, Lee SW, Kim MK, Kim SG, Park YW, Park SW, et al. Correction of post-traumatic lower lip asymmetry using botulinum toxin type A. J Korean Assoc Maxillofac Plast Reconstr Surg. 2013;35:256–259.
7. Ansved T, Odergren T, Borg K. Muscle fiber atrophy in leg muscles after botulinum toxin type A treatment of cervical dystonia. Neurology. 1997;48:1440–1442. doi: 10.1212/WNL.48.5.1440. [PubMed] [CrossRef]
8. Kün-Darbois J-D, Libouban H, Chappard D. Botulinum toxin in masticatory muscles of the adult rat induces bone loss at the condyle and alveolar regions of the mandible associated with a bone proliferation at a muscle enthesis. Bone. 2015;77:75–82. doi: 10.1016/j.bone.2015.03.023. [PubMed] [CrossRef]
9. Tsai CY, Lei YY, Yang LY, Chiu WC. Changes of masseter muscle activity following injection of botulinum toxin type A in adult rats. Orthod Craniofac Res. 2015;18:202–211. doi: 10.1111/ocr.12095. [PubMed] [CrossRef]
10. Blitzer A, Brin MF, Greene PE, Fahn S. Botulinum toxin injection for the treatment of oromandibular dystonia. Ann Otol Rhinol Laryngol. 1989;98:93–97. doi: 10.1177/000348948909800202. [PubMed] [CrossRef]
11. Kim HS, Yun PY, Kim YK. A clinical evaluation of botulinum toxin-A injections in the temporomandibular disorder treatment. Maxillofac Plast Reconstr Surg. 2016;38:5. doi: 10.1186/s40902-016-0051-7. [PMC free article] [PubMed] [CrossRef]
12. von Lindern JJ, Niederhagen B, Appel T, Bergé S, Reich RH. Type A botulinum toxin for the treatment of hypertrophy of the masseter and temporal muscles: an alternative treatment. Plast Reconstr Surg. 2001;107:327–332. doi: 10.1097/00006534-200102000-00004. [PubMed] [CrossRef]
13. Duchen L, Strich SJ. The effects of botulinum toxin on the pattern of innervation of skeletal muscle in the mouse. Q J Exp Physiol Cogn Med Sci. 1968;53:84–89. [PubMed]
14. Arora R, Yates C, Gary BD, McClellan S, Tan M, Xi Y, et al. Panepoxydone targets NF-kB and FOXM1 to inhibit proliferation, induce apoptosis and reverse epithelial to mesenchymal transition in breast cancer. PLoS One. 2014;9(6):e98370. doi: 10.1371/journal.pone.0098370. [PMC free article] [PubMed] [CrossRef]
15. Warden SJ, Galley MR, Richard JS, George LA, Guildenbecher EA, Judd AM, et al. Reduced gravitational loading does not account for the skeletal effect of botulinum toxin-induced muscle inhibition suggesting a direct effect of muscle on bone. Bone. 2013;54:98–105. doi: 10.1016/j.bone.2013.01.043. [PMC free article] [PubMed] [CrossRef]
16. von Lindern JJ, Niederhagen B, Bergé S, Appel T. Type A botulinum toxin in the treatment of chronic facial pain associated with masticatory hyperactivity. J Oral Maxillofac Surg. 2003;61:774–778. doi: 10.1016/S0278-2391(03)00153-8. [PubMed] [CrossRef]
17. Moon YM, Kim YJ, Kim MK, Kim SG, Kweon HY, Kim TW. Early effect of Botox-A injection into the masseter muscle of rats: functional and histological evaluation. Maxillofac Plast Reconstr Surg. 2015;37:46. doi: 10.1186/s40902-015-0049-6. [PMC free article] [PubMed] [CrossRef]
18. Ilg EC, Schäfer BW, Heizmann CW. Expression pattern of S100 calcium‐binding proteins in human tumors. Int J Cancer. 1996;68:325–332. doi: 10.1002/(SICI)1097-0215(19961104)68:3<325::AID-IJC10>3.0.CO;2-7. [PubMed] [CrossRef]
19. Mischke D, Korge BP, Marenholz I, Volz A, Zieqler A. Genes encoding structural proteins of epidermal cornification and S100 calcium-binding proteins form a gene complex (“epidermal differentiation complex”) on human chromosome 1q21. J Invest Dermatol. 1996;106:989–992. doi: 10.1111/1523-1747.ep12338501. [PubMed] [CrossRef]
20. Heatwole VM (1999) TUNEL assay for apoptotic cells. Immunocytochemical Methods and Protocols. Springer, Heidelberg, p 141–148 [PubMed]
21. Wu SH, Huang SH, Cheng KI, Chai CY, Yeh JL, et al. Third-degree hindpaw burn injury induced apoptosis of lumbar spinal cord ventral horn motor neurons and sciatic nerve and muscle atrophy in rats. BioMed Res Int. 2015;2015:372819. [PMC free article] [PubMed]
22. Magnusson-Lind A, Davidsson M, Silajdžić E, Hansen C, McCourt AC, Tabrizi SJ, et al. Skeletal muscle atrophy in r6/2 mice-altered circulating skeletal muscle markers and gene expression profile changes. J Huntingtons Dis. 2014;3:13–24. [PubMed]
23. Kim HC, Song JM, Kim CJ, Yoon SY, Kim IR, Park BS, et al. Combined effect of bisphosphonate and recombinant human bone morphogenetic protein 2 on bone healing of rat calvarial defects. Maxillofac Plast Reconstr Surg. 2015;37:16. doi: 10.1186/s40902-015-0015-3. [PMC free article] [PubMed] [CrossRef]
24. Vegger JB, Brüel A, Thomsen JS. Vertical trabeculae are thinned more than horizontal trabeculae in skeletal-unloaded rats. Calcif Tissue Int. 2015;97:516–526. doi: 10.1007/s00223-015-0035-0. [PubMed] [CrossRef]
25. Yamaki T, Wu CL, Gustin M, Lim J, Jackman RW, Kandarian SC. Rel A/p65 is required for cytokine-induced myotube atrophy. Am J PhysiolCell Physiol. 2012;303:C135–C142. doi: 10.1152/ajpcell.00111.2012. [PMC free article] [PubMed] [CrossRef]
26. Sorci G, Riuzzi F, Agneletti AL, Marchetti C, Donato R. S100B causes apoptosis in a myoblast cell line in a RAGE‐independent manner. J Cell Physiol. 2004;199:274–283. doi: 10.1002/jcp.10462. [PubMed] [CrossRef]
27. Seo BN, Ryu JM, Yun SP, Jeon JH, Park SS, Oh KB, et al. Delphinidin prevents hypoxia-induced mouse embryonic stem cell apoptosis through reduction of intracellular reactive oxygen species-mediated activation of JNK and NF-kB, and Akt inhibition. Apoptosis. 2013;18:811–824. doi: 10.1007/s10495-013-0838-2. [PubMed] [CrossRef]
28. Heizmann CW. The calcium signal is transmitted into an intracellular response via the families of calcium-binding proteins which are thought to be involved in the regulation of many cellular activities. Calcium Transport and Intracellular Calcium Homeostasis. Lyon: NATO Advanced Research Workshop; 2013. p. 301.
29. Mishra SK, Siddique HR, Saleem M. S100A4 calcium-binding protein is key player in tumor progression and metastasis: preclinical and clinical evidence. Cancer Metastasis Rev. 2012;31:163–172. doi: 10.1007/s10555-011-9338-4. [PubMed] [CrossRef]
30. Yu SP, Canzoniero LM, Choi DW. Ion homeostasis and apoptosis. Curr Opin Cell Biol. 2001;13:405–411. doi: 10.1016/S0955-0674(00)00228-3. [PubMed] [CrossRef]
31. Riuzzi F, Sorci G, Donato R. S100B stimulates myoblast proliferation and inhibits myoblast differentiation by independently stimulating ERK1/2 and inhibiting p38 MAPK. J Cell Physiol. 2006;207:461–470. doi: 10.1002/jcp.20580. [PubMed] [CrossRef]
32. Moon YM, Kim MK, Kim SG, Kim TW. Apoptotic action of botulinum toxin on masseter muscle in rats: early and late changes in the expression of molecular markers. Springerplus. 2016;5:991. doi: 10.1186/s40064-016-2680-9. [PMC free article] [PubMed] [CrossRef] |


