马上注册,结交更多好友,享用更多功能,让你轻松玩转社区。
您需要 登录 才可以下载或查看,没有账号?注册
×
概要
在过去的二十年里,出现了重大证据,这些证据改变了急性胰腺炎管理的某些方面。虽然大多数急性胰腺炎病例是轻微的,但在治疗严重病例和与急性胰腺炎相关的并发症方面存在挑战。胆结石仍然是最常见的原因,流行病学趋势表明发病率上升。急性胆石性胰腺炎的外科治疗已经发展。在本文中,作者重新审视并回顾了诊断急性胰腺炎的方法。作者提出了支持性治疗病情的证据,然后讨论了急性胆源性胰腺炎的治疗方法。基于证据,作者的当地制度路径和临床经验,作者制定了一个大纲,指导临床医生管理急性胆石性胰腺炎。
关键词:急性胰腺炎,严重程度评分,诊断影像学,胆石性胰腺炎的处理
介绍
一名患者抱怨突然发生上腹部疼痛,伴有恶心和呕吐,需要迅速排除涉及心血管(心肌梗塞,破裂和/或解剖主动脉瘤)和胃肠道的各种危及生命的疾病。 (消化性溃疡病伴有穿孔或出血,急性胰腺炎)系统。临床医生的病史和检查结果通过相关调查得到加强,缩小了鉴别诊断,最终指导了某种疾病及其相关并发症的管理和治疗。
英国急性胰腺炎的发病率为每年每10万人约56例,1 在美国,每年超过220,000例住院患者归因于急性胰腺炎。2 利用英国和欧洲数据的流行病学研究表明,所有患者的发病率均在增加。 - 急性胰腺炎。3 急性胰腺炎的发病率也随着年龄的增长而增加。3,4 男性人群的发病率比女性高10%-30%。4 尽管病例的死亡率有所降低。在所有入院的急性胰腺炎患者中,约有20%-30%的患者有严重的病程[1],而在这些患者中约有25%会出现严重的危及生命的并发症.4重症急性胰腺炎的死亡率可高达30%,2但急性胰腺炎的总死亡率估计为5%。1
胆结石仍然是急性胰腺炎的最常见原因。胆结石相关性急性胰腺炎约占所有英国病例的一半,而高达25%的急性胰腺炎病例可归因于酒精.1 流行病学数据显示,英国和欧洲国家的胆石性胰腺炎发病率线性增加 。然而,与欧洲研究相比,英国的酒精性胰腺炎发病率要低得多。3 酒精性急性胰腺炎在中年男性中更为常见。特发性急性胰腺炎占病例的20%-34%,男性和女性的发病率相似。3 特发性急性胰腺炎的发病率取决于临床医生调查患者急性胰腺炎发病原因的程度。实验室病理学测试和放射成像技术的最新进展有助于减少标记为特发性的急性胰腺炎病例的数量。
男性和女性胆结石相关性急性胰腺炎的发病率随年龄增长而增加,60岁以上的女性风险较高。2,3 胆结石小于5 mm的患者,微小结石或胆汁污泥被认为是胆石性胰腺炎的风险较高。微小症引起Oddi括约肌的功能性梗阻,随后导致胆汁和/或胆胰分泌物反流,从而损伤胰管。5 急性胆源性胰腺炎发病机制中的共同通道理论已被一些人反驳。据推测,急性胆源性胰腺炎是继发于导管阻塞的胰腺腺泡过度刺激引起胰蛋白酶释放的结果,其诱导一系列酶导致的胰腺和胰周炎症。[6]其他人推测十二指肠内容物反流更多是胰腺的致病因素。导管损伤比胆汁反流。7 有多种理论涉及急性胰腺炎的发病机制,但仍有争议。
胰腺酶的不适当释放和活化诱导急性胰腺炎。胰腺酶原激活的关键酶被认为是胰蛋白酶。胰蛋白酶原对胰蛋白酶的不适当激活以及胰蛋白酶缺乏快速胰腺清除导致胰腺炎症并随后引发炎症级联.2细胞因子包括白细胞介素(IL)-1,IL-6,IL-8,肿瘤坏死因子a,和血小板活化因子被释放.7这些反过来诱导急性期反应蛋白如C-反应蛋白(CRP)的肝合成。白细胞迁移和活化可能是局部和全身并发症的主要决定因素。4
诊断急性胰腺炎
在2005年的指南中,英国急性胰腺炎工作组提出,应该在至少80%的急性胰腺炎病例中确定病因。此外,特发性急性胰腺炎病例的分类应不超过20%。8 因此,对患者进行广泛调查以确定潜在的病因。
急性胰腺炎的预测概率取决于临床医生的怀疑指数,这主要取决于患者的病史和临​​床医生的检查结果。4 经典教学是血清淀粉酶水平比上限高出三到四倍。正常是诊断急性胰腺炎。虽然测量血清胰酶如淀粉酶是诊断急性胰腺炎的“金标准”,但血清胰酶的测量值应该通过考虑患者症状的持续时间来解释。
在急性胰腺炎中,胰酶淀粉酶,脂肪酶,弹性蛋白酶和胰蛋白酶同时释放到血流中。由于这些酶的清除率各不相同,从急性胰腺炎开始采血的时间会影响试验的敏感性。4 与淀粉酶相比,脂肪酶具有更高的诊断准确性,因为血清脂肪酶水平会升高一段时间.9在解释高甘油三酯血症患者的淀粉酶结果时应该谨慎,因为它们可能具有错误的低淀粉酶结果。
在急性胰腺炎发作期间,丙氨酸氨基转移酶升高至> 150 IU / L是急性胰腺炎胆道病因的预测因素.10之前的荟萃分析表明,丙氨酸氨基转移酶的三倍升高具有阳性预测值。 95%诊断急性胆石性胰腺炎。11
胰蛋白酶原激活肽(TAP)和胰蛋白酶原-2的生化测量由于其准确性而更有用作急性胰腺炎的诊断标志物,但其评估受到可用性的限制。9 早期升高的尿TAP水平已被证明是相关的其他标志物如IL-6和IL-8,9以及磷脂酶A2已在其他地方得到了很好的总结,12 并且在英国的临床实践中并未常规测量。
治疗急性胰腺炎
严重程度分类
掌握急性胰腺炎的管理是一种艺术,可以在最好的时候挑战有经验的临床医生。管理急性胰腺炎的一个方面是疾病严重程度的分类,以便人们可以识别,预测和治疗疾病的并发症。修订后的2012年亚特兰大急性胰腺炎严重程度分类标准被广泛接受。13 该修订后的分类将暂时性器官衰竭定义为器官衰竭,其在48小时内完全消退,而器官衰竭的解决失败被定义为持续性。持续性器官衰竭的存在,通常伴有一种或多种局部并发症,表明严重的急性胰腺炎。另一方面,没有任何局部或全身并发症的器官衰竭的缺失表明轻度急性胰腺炎。 “中度重症急性胰腺炎”表现为暂时性器官衰竭和/或在没有持续性器官衰竭的情况下的局部或全身并发症,是在修订后的分类中引入的轻度和重度严重程度的新等级。13 多重评分系统预测疾病的严重程度和预后意义[12,14]。预后特征有助于临床医生预测急性胰腺炎的并发症。8
与其他评分系统相比,急性生理学和慢性健康评估(APACHE)II评分系统已经证明了预测重症急性胰腺炎的最高准确性.15基于文献证据的其他重症急性胰腺炎标志物已在方框1中概述。 APACHE II评分可以每天重复,其趋势与临床进展或恶化相关。然而,APACHE II与多因素评分系统(如Ranson,计算机断层扫描严重程度指数(CTSI),15,16 和急性胰腺炎严重程度的床旁指数)之间的预后准确性无显著差异。17
方框1
临床,生物化学和放射学标志物,有助于分类急性胰腺炎发作的严重程度
肥胖4,8
入学时APACHE II得分≥8,8,8,20
入院时器官功能障碍的证据
入院后48小时CRP≥150mg/ L4,8,12,18,20
格拉斯哥入院后48小时评分> 3,16
对比增强CT(CECT)坏死的证据25
降钙素原> 1.8 ng / mL19,24
注意:这些有助于临床医生识别应该早期进行重症监护输入或治疗的患者。具有上述任何组合的患者应归类为重症急性胰腺炎,并因此在升级的护理水平内监测并发症。
缩写:APACHE,急性生理学和慢性健康评估; CRP,C-反应蛋白。
CRP是评估严重程度的可靠,易于访问的单一标记。在入院后48小时测量时,它已显示出对重症急性胰腺炎,胰腺坏死和院内死亡率具有良好的预后准确性。18,19 另一种便宜且易于获得的指示急性胰腺炎严重程度的参数是血细胞比容。入院时血细胞比容≥44%或血细胞比容未能在入院后24小时降低,表明疾病早期出现严重急性胰腺炎。20 此外,一些研究表明血液浓缩与发生坏死的风险有关。胰腺炎和器官衰竭,20,21,而其他人反驳这一观察结果。22,23 入院时血红蛋白浓缩的缺乏对坏死的发展有较高的阴性预测价值。22,23 其他标志物如降钙素原 19,24 和IL-8,在英国没有常规使用,已经证明在疾病的头几天对坏死性胰腺炎的严重程度进行分类具有很高的预测准确性。
炎症反应在每个患者之间变化。胰腺内酶的释放引发腺泡细胞内促炎介质和巨噬细胞活化的释放,导致急性胰腺炎的局部并发症,包括有或没有感染的胰腺坏死,胰腺假性囊肿形成,胰管破裂和胰周血管并发症。目前尚不清楚为什么在一些患者中局部胰腺炎症会引发促炎介质的全身释放。然而,这种全身性炎症反应表现为器官衰竭,其识别和治疗在改变急性胰腺炎的临床过程中是重要的。
成像
影像学在急性胰腺炎的诊断和治疗中起着重要作用。由于50%的急性胰腺炎病例与胆结石相关,经腹超声是最常见的初始放射学检查选择。超声检查对胆囊结石的检测灵敏度最高,但对胆总管结石的敏感性较差(表1)。腹膜后位置的胰腺通常难以在超声检查期间在急性胰腺炎中可视化,其可以通过覆盖的肠气,大的患者身体习惯和腹痛进一步加剧。在评估胆结石的存在与否时,建议至少进行两次高质量的超声检查。如果第一次检查结果为阴性并且无法检测胆结石,那么可能最初错过的最敏感的胆结石诊断检查仍然是进一步的超声检查。4
表格1
比较诊断胆总管结石时可用的不同成像方式
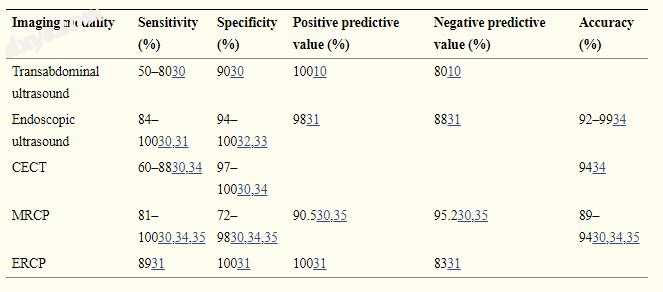
缩写:CECT,对比增强CT; ERCP,内镜逆行胰胆管造影术; MRCP,磁共振胰胆管造影术。
在疑似急性胰腺炎患者中,动态对比增强CT(CECT)是首选的成像方式。 CECT在确定诊断,确定疾病严重程度以及协助检测并发症方面发挥作用[4,25]然而,必须记住,严重程度的分期和并发症的检测取决于CT的时间扫描。在最初的24-48小时内,坏死的CT发现可能是模棱两可的,因为只有25%的急性胰腺炎患者发生坏死。此外,在重症急性胰腺炎中,胰腺坏死可能不会发生。20 在重症急性胰腺炎中,除非患者病情严重且需要紧急干预,否则最好在症状出现后至少72小时进行CT扫描。4
从CTSI的发展可以明显看出,CECT在胰腺坏死部位和/或程度的定位中的使用增强了结果预测的准确性。高CTSI评分与严重程度和预后恶化,胰腺感染和干预需求相关[26,27]例如,与整个胰腺受累的患者相比,胰头坏死患者的预后相似.28改良CTSI开发用于评估急性胰腺炎的严重程度,但与原始CTSI相比,未观察到显著差异。然而,与APACHE II严重程度评分系统相比,两种CTSI评分系统在诊断临床重症急性胰腺炎方面均表现出更高的准确性。29
磁共振胰胆管成像(MRCP)形式的磁共振成像已成为评估胆管和胰管的常用成像方式。在专栏2中概述了其在急性胰腺炎中的益处.MRCP在诊断胆总管结石方面是可靠的,并且仅在内窥镜超声(EUS)中用于检测胆总管结石的灵敏度被取代(方框2)。 MRCP的局限性包括心脏起搏器和其他金属物体患者的禁忌症,长图像采集时间以及扫描重症患者的困难。
MRCP和EUS的出现大大减少了ERCP作为胆总管结石诊断工具的需求。 EUS是胆总管结石最可靠的治疗前诊断方式,34 当与MRCP一起使用时,与ERCP相比,两种成像方式都提供了一种更安全的胆总管结石检查方法,ERCP本身与术后胰腺炎的风险相关。 EUS在微石症的评估中特别有用,微胆结石被认为是患者中复发性急性胰腺炎的原因,没有使用其他成像方式可见胆总管结石的证据。 EUS还赋予评估导管异常的能力。
方框2
磁共振成像在急性胰腺炎中的益处。36
非电离辐射 - 用于跟踪重复扫描的患者;
能够检测胆总管结石;
能够证明存在断开的胰管 - 有助于预测并发症和某些预后价值;
能够表征胰腺和实质的集合或脓肿 - 检测急性胰腺炎的并发症,从而指导管理;
通过血管造影,可用于识别胰腺或胰周收集物或假性囊肿内的出血,并识别假性动脉瘤以指导进一步的治疗。
急性胰腺炎的液体治疗
急性胰腺炎的初始治疗在很大程度上是支持性的,可更换液体并优化电解质平衡,提供足够的热量支持,以及预防或识别和治疗局部和全身并发症。
急性胰腺炎中的局部和全身炎症反应导致呕吐形式的液体耗尽,口腔液体摄入减少,第三空间液体流失以及汗液和呼吸中不敏感的损失增加。急性胰腺炎中的液体替代可以使用晶体,胶体或两者的组合进行。林格氏乳酸盐是首选的晶体液,但在高钙血症患者中应谨慎行事。有关液体复苏建议的文献证据已在前面进行了总结。但是,到目前为止,尚未就理想的液体类型和液体复苏方案达成明确的一致意见.39,40液体复苏的目标是实现尿液输出≥0.5mL/ kg / h,目标心率<120 / min,血细胞比容保持在35%~44%之间。39 补充氧气应补充液体复苏,维持动脉血氧饱和度> 95%。
急性胰腺炎的营养
由于高分解代谢状态,急性胰腺炎导致脂肪和蛋白质的快速代谢。营养支持旨在提供足够的热量摄入并调节急性胰腺炎初始阶段的氧化应激反应,从而抵消分解代谢作用。41 此外,肠内营养保持肠道运动,保持肠道屏障功能,从而降低继发风险感染 - 据推测,急性胰腺炎的感染性并发症是由于肠道细菌移位,肠道蠕动改变,细菌过度生长和肠道通透性增加所致。39 急性胰腺炎肠内营养与全肠外营养相比与更好的临床结果相关。42
立即口服营养,引入软饮食,43 低脂固体饮食,44 或全固体饮食 45 对轻度急性胰腺炎患者的疼痛安定是安全的。轻度急性胰腺炎的口服营养已被证明可以缩短住院时间,并且在开始再次给药后没有明显的疼痛复发[43,45]。但是,在早期口服再喂食后疼痛复发的患者应该谨慎行事,因为显示可以增加住院时间。46
在重症急性胰腺炎患者中,有充分证据表明肠内营养优于全肠外营养。全胃肠外营养与局部和全身感染并发症,多器官衰竭和死亡率显著增加有关。42,47,48 入院后48小时内肠内营养调节炎症和脓毒症反应,41,49 表明临床显著减少在一项研究中,所有感染和死亡率均为50例。然而,两项随机临床试验比较了早期肠内营养与急性重症胰腺炎延迟肠内营养,未能证明早期肠内营养在减少这些患者的并发症,器官衰竭和死亡方面具有优势。51 ,52 肠内营养可通过鼻胃管和鼻空肠途径给药。鼻胃管营养是安全的,并且与重症急性胰腺炎的鼻空肠营养具有相似的结果。53,54 英国急性胰腺炎工作组建议在重症急性胰腺炎患者中使用肠内途径进行营养支持,如果耐受的话。它还承认,支持在所有重症急性胰腺炎患者中使用肠内营养的证据尚无定论
急性胰腺炎的抗生素治疗
急性胰腺炎的继发感染并发症与死亡率增加有关.8在所有医疗保健领域广泛使用抗菌治疗导致需要有针对性的抗菌治疗以获得更好的结果,同时最大限度地降低发生抗菌素耐药性的风险。与关于急性胰腺炎营养的争论一样,在急性胰腺炎中使用抗生素存在争议。
负责感染性坏死的微生物谱正在发生变化。虽然革兰氏阴性需氧细菌通常在感染胰腺坏死的培养物中产生,但革兰氏阳性菌,厌氧菌和真菌也被分离出来。55 青霉素,第一代头孢菌素,氨基糖苷类和四环素类药物对急性胰腺炎无效。对革兰氏阴性细菌如亚胺培南,克林霉素,哌拉西林,氟喹诺酮和甲硝唑有活性的抗生素在感染的胰腺坏死中具有足够的组织渗透和杀菌特性。56 与其他静脉注射抗生素相比,碳青霉烯类与死亡率显著降低有关,而亚胺培南的使用显著降低了感染性胰腺坏死的发生率。55,57 在解释荟萃分析的结果时应谨慎,因为患者数量相对较小。57,59
二十年前进行的研究集中在使用抗生素预防来预防重症急性胰腺炎的感染性并发症。 这些研究的系统评价和荟萃分析表明,抗生素预防可降低死亡率。58,59 二十年后,现在有充分的证据表明急性胰腺炎患者接受预防性抗生素治疗后死亡率没有显著下降。此外,预防性抗生素与胰腺坏死感染并发症的显著减少无关。57,60,61
急性胰腺炎的外科手术治疗
急性胰腺炎的外科治疗可分为急性胆源性胰腺炎的外科治疗和急性胰腺炎并发症的外科治疗。 图1总结了轻度急性胰腺炎的治疗方法,包括病因与胆结石有关的病例。
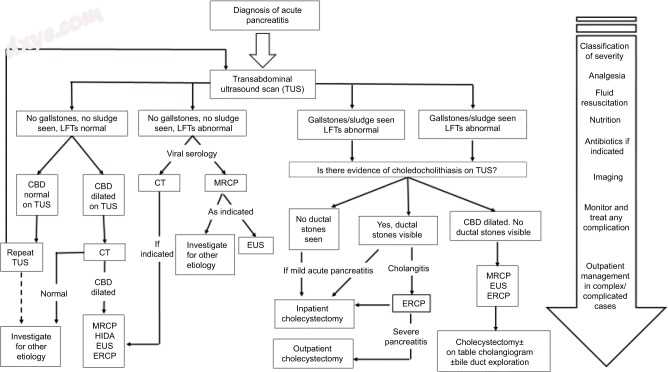
图1
一个流程图,包括患者从急性胰腺炎诊断到进一步调查和最终管理的过程。
缩写:CBD,胆总管; CT,计算机断层扫描; ERCP,内镜逆行胰胆管造影术; EUS,内镜超声; HIDA,脂肪餐肝胆亚氨基二乙酸扫描; LFT,肝功能检查; MRCP,磁共振胰胆管造影术; TUS,经腹超声检查。
对于适合胆囊切除术的轻度急性胆源性胰腺炎患者,指南建议理想情况下应在指数入院时进行,62 并且不应延迟> 2周。8,63 该队列患者的早期腹腔镜胆囊切除术另一方面,对接受间歇性(延迟性)胆囊切除术的轻度急性胆源性胰腺炎患者进行的研究发现,复发性胆道事件再入院的风险很高[8,65]。对于高危患者或不适合胆囊切除术,或在指数入院期间住院胆囊切除术不可行的中心,单独使用ERCP和内镜下括约肌切开术(ES)就足够了。 ES可将第二次胰腺炎发作的短期风险降低至少50%。4
所有患有急性胆石性胰腺炎的患者都应该对胆总管进行成像以评估胆总管结石(方框2)。术前成像采用非侵入性方法,如经腹超声和/或MRCP,术中胆管造影提供胆总管的实时成像。胆总管结石的管理依赖于当地专业知识的可用性,可大致分为1)单阶段方法 - 腹腔镜或开腹胆囊切除术与术中胆管造影和胆总管探查,或2)两阶段方法 - 术前ERCP有无ES随后进行腹腔镜或开腹胆囊切除术。两种胆总管结石治疗方法的发病率,死亡率,保留结石和失败率无显著差异。66,67
在具有适当外科专业知识的中心允许对轻度急性胆石性胰腺炎进行单阶段确定性治疗的中心,已经取得了有希望的结果。尽管选择患有无并发症的轻度急性胆源性胰腺炎的患者可能会导致并发症和转换率较低[68,69]。如果对保留的结石或替代病变有任何疑虑,术后MRCP和/或ERCP是临床医生可用的选择。 68腹腔镜胆囊切除术与术前ES的结合也证明了治疗急性胆源性胰腺炎时胆总管结石的安全可靠的方法。70
对于伴有胆总管结石和/或胆管炎的严重急性胆源性胰腺炎患者,有证据表明入院后72小时内进行ERCP可降低该组患者的发病率和死亡率。71 此外,ERCP可减少急性期患者的住院时间。严重的胆石性胰腺炎。迄今为止,没有证据表明或反对早期腹腔镜胆囊切除术治疗严重急性胆源性胰腺炎患者。
急性胰腺炎的局部并发症包括有或没有感染的胰腺坏死,胰腺假性囊肿形成,胰管破裂和胰周血管并发症。这些局部并发症可以通过内镜,放射学和外科技术相结合进行管理,并且已在之前进行过综述。72 开放式外科清创需要多次剖腹手术,因此与术后高发病率相关。然而,手术技术已经发展为微创,这可能与更好的结果有关
“臭鼬手术”利用成像将导管(引流管)从其导丝上推进到小囊内的感染区域。一旦导管处于令人满意的位置,就开始闭合连续灌洗。当进行视频辅助微创腹膜后胰腺坏死切除术时,引流导管便于进入小囊的通路。感染的胰腺坏死或胰腺假性囊肿的内窥镜经胃或十二指肠引流是与开放式外科清创术相比具有较低发病率的另一种技术。处理急性胰腺炎并发症的微创技术需要采用多学科方法,具有专业人员,技能和设备。理想情况下,这些程序应在具有管理任何并发症的现成专业知识的中心进行。
结论
急诊手术时经常会遇到急性胰腺炎。一旦做出诊断,临床工作应同时集中于调查潜在的病因并通过预测其并发症来控制病情,这可以通过使用所描述的任何严重性评分系统来辅助。急性胰腺炎的治疗在很大程度上是支持性的。对于用于复苏的理想液体类型和方案仍然没有达成共识,但是目标导向的液体治疗与更好的结果相关。早期肠内营养通过减少急性胰腺炎的感染性并发症来调节炎症反应并改善预后。应谨慎使用抗生素,因为预防性抗生素在预防急性胰腺炎的感染性并发症方面没有任何益处。建议患有轻度急性胆石性胰腺炎的患者在入院时进行腹腔镜胆囊切除术,而患有严重胆石性胰腺炎和胆管炎和/或胆总管结石的患者应从早期ERCP中获益。轻度急性胆石性胰腺炎和并发胆总管结石患者可从单阶段腹腔镜胆囊切除术和胆管探查中获益,但需遵守当地的专业知识。胆总管结石的单阶段和双阶段治疗的死亡率和发病率没有差异。然而,单阶段方法减少了住院时间和复发入院的需要。
参考:
Acute pancreatitis: current perspectives on diagnosis and management
1. NICE . Pancreatitis: Diagnosis and Management Draft Scope for Consultation. National Institute for Clinical Excellence; London, UK: 2016.
2. Whitcomb DC. Acute pancreatitis. N Engl J Med. 2006;354(20):2142–2150. [PubMed]
3. Yadav D, Lowenfels AB. Trends in the epidemiology of the first attack of acute pancreatitis. Pancreas. 2006;33(4):323–330. [PubMed]
4. Toouli J, Brooke-Smith M, Bassi C, et al. Guidelines for the management of acute pancreatitis. J Gastroenterol Hepatol. 2002;17:515–539.
5. Venneman NG, van Brummelen SE, van Berge-Henegouwen P, van Erpecum KJ. Microlithiasis: an important cause of “idiopathic” acute pancreatitis? Ann Hepatol. 2003;2(1):30–35. [PubMed]
6. Wang GJ, Gao CF, Wei D, Wang C, Ding SQ. Acute pancreatitis: etiology and common pathogenesis. World J Gastroenterol. 2009;15(12):1427–1430. [PMC free article] [PubMed]
7. Sakorafas GH, Tsiotou AG. Etiology and pathogenesis of acute pancreatitis: current concepts. J Clin Gastroenterol. 2000;30(4):343–356. [PubMed]
8. UK Working Party on Acute Pancreatitis UK guidelines for the management of acute pancreatitis. Gut. 2005;54(Suppl 3):1–9. [PMC free article] [PubMed]
9. Matull WR, Pereira SP, O’Donohue JW. Biochemical markers of acute pancreatitis. J Clin Pathol. 2006;59(4):340–344. [PMC free article] [PubMed]
10. Ammori B, Boreham B, Lewis P, Roberts S. The biochemical detection of biliary etiology of acute pancreatitis on admission: a revisit in the modern era of biliary imaging. Pancreas. 2003;26(2):e32–e35. [PubMed]
11. Tenner S, Dubner H, Steinberg W. Predicting gallstone pancreatitis with laboratory parameters: a meta-analysis. Am J Gastroenterol. 1994;89(10):1863–1866. [PubMed]
12. Carroll J, Herrick B, Gipson T, Lee S. Acute pancreatitis: diagnosis, prognosis and treatment. Am Fam Physician. 2007;75(10):1513–1520. [PubMed]
13. Banks PA, Bollen TL, Dervenis C, et al. Classification of acute pancreatitis 2012: revision of the Atlanta classification and definitions by international consensus. Pancreas. 2013;62(1):102–111. [PubMed]
14. BMJ Acute pancreatitis. BMJ Best Practice. 2017. [Accessed October 2017]. Available from: http://bestpractice.bmj.com/best ... osis/criteria.html.
15. Cho JH, Kim TN, Chung HH, Kim KH. Comparison of scoring systems in predicting the severity of acute pancreatitis. World J Gastroenterol. 2015;21(8):2387–2394. [PMC free article] [PubMed]
16. Wilson C, Heath DI, Imrie CW. Prediction of outcome in acute pancreatitis: a comparative study of APACHE II, clinical assessment and multiple factor scoring systems. Br J Surg. 1990;77(11):1260–1264. [PubMed]
17. Papachristou GI, Muddana V, Yadav D, et al. Comparison of BISAP, Ranson’s, APACHE II, and CTSI scores in predicting organ failure, complications, and mortality in acute pancreatitis. Am J Gastroenterol. 2010;105(2):435–441. [PubMed]
18. Cardoso F, Ricardo L, Oliveira A, et al. C-reactive protein prognostic accuracy in acute pancreatitis: timing of measurement and cut-off points. Eur J Gastroenterol Hepatol. 2013;25(7):784–789. [PubMed]
19. Staubli S, Oertli D, Nebiker C. Laboratory markers predicting severity of acute pancreatitis. Crit Rev Clin Lab Sci. 2015;52(6):273–283. [PubMed]
20. Berger HG, Rau BM. Severe acute pancreatitis: clinical course and management. World J Gastroenterol. 2007;13(38):5043–5051. [PMC free article] [PubMed]
21. Muddana V, Whitcomb D, Khalid A, Slivka A, Papachristou G. Elevated serum creatinine as a marker of pancreatic necrosis in acute pancreatitis. Am J Gastroenterol. 2009;104(1):164–170. [PubMed]
22. Lankisch P, Mahlke R, Blum T, Bruns A, Maisonneuve P, Lowenfels A. Hemoconcentration: an early marker of severe and/or necrotizing pancreatitis? A critical appraisal. Am J Gastroenterol. 2001;96(7):2081–2085. [PubMed]
23. Gardner T, Olenec C, Chertoff J, Mackenzie T, Robertson D. Hemoconcentration and pancreatic necrosis: further defining the relationship. Pancreas. 2006;33(2):169–173. [PubMed]
24. Kylanpaa-Back ML, Takala A, Kemppainen E, Puolakkainen P, Haapiainen R, Repo H. Procalcitonin strip test in the early detection of severe acute pancreatitis. Br J Surg. 2001;88(2):222–227. [PubMed]
25. Balthazar E. CT diagnosis and staging of acute pancreatitis. Radiol Clin North Am. 1989;27(1):19–37. [PubMed]
26. Balthazar E, Robinson D, Megibow A, Ranson J. Acute pancreatitis: value of CT in establishing prognosis. Radiology. 1990;174(2):331–336. [PubMed]
27. Simchuk EJ, Traverso LW, Nukui Y, Kozarek RA. Computed tomography severity index is a predictor of outcomes for severe pancreatitis. Am J Surg. 2000;179(5):352–355. [PubMed]
28. Wyncoll DL. The management of severe acute necrotising pancreatitis: an evidence-based review of the literature. Intensive Care Med. 1999;25:146–156. [PubMed]
29. Bollen T, Singh V, Maurer R, et al. Comparative evaluation of the modified CT severity index and CT severity index in assessing severity of acute pancreatitis. Am J Roentgenol. 2011;11(2):386–392. [PubMed]
30. Surlin V, Saftoiu A, Dumitrescu D. Imaging tests for accurate diagnosis of acute biliary pancreatitis. World J Gastroenterol. 2014;20(44):16544–16549. [PMC free article] [PubMed]
31. Prat F, Amouyal G, Amouyal P, et al. Prospective controlled study of endoscopic ultrasonography and endoscopic retrograde cholangiography in patients with suspected common-bileduct lithiasis. Lancet. 1996;347(8994):75–79. [PubMed]
32. Garrow D, Miller S, Sinha D, et al. Endoscopic ultrasound: a meta-analysis of test performance in suspected biliary obstruction. Clin Gastroenterol Hepatol. 2007;5:616–623. [PubMed]
33. Tse F, Liu L, Barkun A, Armstrong D, Moayyedi P. EUS: a meta-analysis of test performance in suspected choledocholithiasis. Gastrointest Endosc. 2008;67(2):235–244. [PubMed]
34. Buscarini E, Buscarini L. The role of endosonography in the diagnosis of choledocholithiasis. Eur J Ultrasound. 1999;10(2–3):117–125. [PubMed]
35. De Waele E, Op de Beeck B, De Waele B, Delvaux G. Magnetic resonance cholangiopancreatography in the preoperative assessment of patients with biliary pancreatitis. Pancreatology. 2007;7(4):347–351. [PubMed]
36. Xiao B, Zhang X, Tang W, Zeng L, Zhai Z. Magnetic resonance imaging for local complications of acute pancreatitis: a pictorial review. World J Gastroenterol. 2010;16(22):2735–2742. [PMC free article] [PubMed]
37. Wu B, Hwang J, Gardner T, et al. Lactated Ringer’s solution reduces systemic inflammation compared with saline in patients with acute pancreatitis. Clin Gastroenterol Hepatol. 2011;9(8):710–717. [PubMed]
38. Aggarwal A, Manrai M, Kochhar R. Fluid resuscitation in acute pancreatitis. World J Gastroenterol. 2014;20(48):18092–18103. [PMC free article] [PubMed]
39. van Dijk SM, Hallsensleben NDL, van Santvoort HC, et al. Acute pancreatitis: recent advances through randomised trials. Gut. 2017;66(11):2024–2032. [PubMed]
40. Haydock M, Mittal A, Wilms H, Phillips A, Petrov M, Windsor J. Fluid therapy in acute pancreatitis: anybody’s guess. Ann Surg. 2013;257(2):182–188. [PubMed]
41. McClave S. Drivers of oxidative stress in acute pancreatitis: the role of nutrition therapy. JPEN J Parenter Enteral Nutr. 2012;36(1):24–35. [PubMed]
42. Al-Omran M, Albalawi Z, Tashkandi M, Al-Ansary L. Enteral versus parenteral nutrition for acute pancreatitis. Cochrane Database Syst Rev. 2010;1:CD002837. [PubMed]
43. Sathiaraj E, Murthy S, Mansard M, Rao G, Mahukar S, Reddy D. Clinical trial: oral feeding with a soft diet compared with clear liquid diet as initial meal in mild acute pancreatitis. Aliment Pharmacol Ther. 2008;28(6):777–781. [PubMed]
44. Jacobson B, Vander Vliet M, Hughes M, Maurer R, McManus K, Banks P. A prospective, randomized trial of clear fluids versus low-fat solid diet as the initial meal in mild acute pancreatitis. Clin Gastroenterol Hepatol. 2007;5(8):946–951. [PMC free article] [PubMed]
45. Moraes J, Felga G, Chebli L, et al. A full solid diet as the initial meal in mild acute pancreatitis is safe and result in shorter length of hospitalization: results from a prospective, randomized, controlled, double-blind clinical trial. J Clin Gastroenterol. 2010;44(7):517–522. [PubMed]
46. Chebli J, Gaburri P, De Souza A, et al. Oral refeeding in patients with mild acute pancreatitis: prevalence and risk factors of relapsing abdominal pain. J Gastroenterol Hepatol. 2005;20(9):1385–1389. [PubMed]
47. Wu B, Banks P. Clinical management of patients with acute pancreatitis. Gastroenterology. 2013;144(6):1272–1281. [PubMed]
48. Marik P, Zaloga G. Meta-analysis of parenteral nutrition versus enteral nutrition in patients with acute pancreatitis. BMJ. 2004;328(7453):1407. [PMC free article] [PubMed]
49. Windsor AC, Kanwar S, Li AG, et al. Compared with parenteral nutrition, enteral feeding attenuates the acute phase response and improve disease severity in acute pancreatitis. Gut. 1998;42(3):431–435. [PMC free article] [PubMed]
50. Li Y, Yu T, Chen G, et al. Enteral nutrition within 48 hours of admission improves clinical outcomes if acute pancreatitis by reducing complications: a meta-analysis. PLoS One. 2013;8(6):e64926. [PMC free article] [PubMed]
51. Bakker OJ, van Brunschot S, van Santvoort HC, et al. Early versus on-demand nasoenteric tube feeding in acute pancreatitis. N Engl J Med. 2014;371:1983–1993. [PubMed]
52. Stimac D, Poropat G, Hauser G, et al. Early nasojejunal tube feeding versus nil-by-mouth in acute pancreatitis: a randomized clinical trial. Pancreatology. 2016;16(4):523–528. [PubMed]
53. Chang Y, Hua-gun F, Xiao Y, Liu J. Nasogastric or nasojejunal feeding in severe acute pancreatitis: a meta-analysis. Crit Care. 2013;17(3):R118. [PMC free article] [PubMed]
54. Eatock FC, Chong P, Menezes N, et al. A randomized study of early nasogastric versus nasojejunal feeding in severe acute pancreatitis. Am J Gastroenterol. 2005;100(2):432–439. [PubMed]
55. Schmid S, Uhl W, Friess H. The role of infection in acute pancreatitis. Gut. 1999;45(2):311–316. [PMC free article] [PubMed]
56. Mourad MM, Evans RP, Kalidindi V, Drorkin L, Dvorkin L, Bramhall SR. Prophylactic antibiotics in acute pancreatitis: endless debate. Ann R Coll Surg Engl. 2017;99(2):107–112. [PMC free article] [PubMed]
57. Villatoro E, Mulla M, Larvin M. Antibiotic therapy for prophylaxis against infection of pancreatic necrosis in acute pancreatitis. Cochrane Database Syst Rev. 2010;5:CD002941. [PubMed]
58. Golub R, Siddiqi F, Pohl D. Role of antibiotics in acute pancreatitis: a meta-analysis. J Gastrointest Surg. 1998;2(6):496–503. [PubMed]
59. Villatoro E, Bassi C, Larvin M. Antibiotic therapy for prophylaxis against infection of pancreatic necrosis in acute pancreatitis. Cochrane Database Syst Rev. 2006;4:CD002941. [PubMed]
60. Mazaki T, Ishii Y, Takayama T. Meta-analysis of prophylactic antibiotic use in acute necrotizing pancreatitis. Br J Surg. 2006;93(6):647–684. [PubMed]
61. Lim C, Lee W, Liew Y, Tang S, Chlebicki M, Kwa A. Role of antobiotic prophylaxis in necrotizing pancreatitis: a meta-analysis. J Gastrointest Surg. 2015;19(3):480–491. [PubMed]
62. Wilson C, de Moya M. Cholecystectomy for acute gallstone pancreatitis: early vs. delayed approach. Scand J Surg. 2010;99:81–85. [PubMed]
63. Association of Upper Gastrointestinal Surgeons . Commissioning Guide: Gallstone Disease. Royal College of Surgeons; London, UK: 2016.
64. Gurusamy K, Nagendran M, Davidson B. Early versus delayed laparoscopic cholecystectomy for acute gallstone pancreatitis. Cochrane Database Syst Rev. 2013;9:CD010326. [PubMed]
65. van Baal M, Besselink M, Bakker O, et al. Timing of cholecystectomy after mild biliary pancreatitis: a systematic review. Ann Surg. 2012;255(5):860–866. [PubMed]
66. Dasari B, Tan C, Gurusamy K, et al. Surgical versus endoscopic treatment of bile duct stones. Cochrane Database Syst Rev. 2013;12:CD003327. [PubMed]
67. Al-Temimi M, Kim E, Chandrasekaran B, et al. Laparoscopic common bile duct exploration versus endoscopic retrograde cholangiapancreatography for choledocholithiasis found at time of laparoscopic cholecystectomy: analysis of a large integrated health care system database. Am J Surg. 2017;214(6):1075–1079. [PubMed]
68. Griniatsos J, Karvounis E, Isla A. Early versus delayed single-stage laparoscopic eradication for both gallstones and common bile duct stones in mild acute biliary pancreatitis. Am Surg. 2005;71(8):682–686. [PubMed]
69. Isla A, Griniatsos J, Rodway A. Single-stage definitive laparoscopic management in mild acute biliary pancreatitis. J Laparoendosc Adv Surg Tech A. 2003;13(2):77–81. [PubMed]
70. Meyer C, Le J, Rohr S, Duclos B, Reimund J, Baumann R. Management of common bile duct stones in a single operation combining laparoscopic cholecystectomy and peroperative endoscopic sphincterotomy. J Hepatobiliary Pancreat Surg. 2002;9(2):196–200. [PubMed]
71. Tse F, Yuan Y. Early routine endoscopic retrograde cholangiopan-creatography strategy versus early conservative management strategy in acute gallstone pancreatitis. Cochrane Database Syst Rev. 2012;5:CD009779. [PubMed]
72. Karakayali F. Surgical and interventional management of complications caused by acute pancreatitis. World J Gastroenterol. 2014;20(37):13412–13423. [PMC free article] [PubMed]
73. Wronski M, Cebulski W, Witkowski B, et al. Comparison between minimally invasive and open surgical treatment in necrotizing pancreatitis. J Surg Res. 2017;210:22–31. [PubMed]
74. Werner J, Feuerbach S, Uhl W, Buchler M. Management of acute pancreatitis: from surgery to interventional intensive care. Gut. 2005;54(3):426–436. [PMC free article] [PubMed] |


