马上注册,结交更多好友,享用更多功能,让你轻松玩转社区。
您需要 登录 才可以下载或查看,没有账号?注册
×
概要
目的
腹腔镜胃切除术被认为是韩国,日本和中国早期胃癌患者的标准治疗方法。然而,十二指肠残端渗漏仍然是胃切除术后致命的并发症。作者进行了一项前瞻性II期研究,以评估腹腔镜加强缝线(LARS)新技术对十二指肠残端的安全性。
材料和方法
本研究所需的患者估计数为100,为期18个月。纳入标准是经腹腔镜远端或全胃切除术和Billroth II或Roux-en-Y重建治疗的组织学证实的胃腺癌。主要终点是术后30天内十二指肠残端渗漏的发生率。次要终点是术后早期结果,直至出院。
结果
在2016年2月至2017年3月期间招募了100名患者。研究组包括65名男性和35名女性患者,平均年龄(年)为62.3。其中,63例(63%)患者合并症。回收的淋巴结的平均数为38.平均手术时间为145分钟,包括7.8分钟的平均LARS时间。没有发生十二指肠残端漏出。发生了13例并发症,1例脾动脉破裂再次手术,1例死亡。
结论
根据这项前瞻性II期研究的结果,LARS可以在短期手术期间安全地进行,而不会发生十二指肠残端渗漏。与非LARS相比,需要进行未来的随机前瞻性对照试验以确认LARS的手术益处。
关键词:胃肿瘤,腹腔镜,胃切除术,加固,十二指肠,渗漏
介绍
根据最近的前瞻性随机对照临床试验结果[1,2],腹腔镜胃切除术已成为韩国,日本和中国早期胃癌的标准治疗方法。几项多中心随机对照试验(RCTs)[3,4,5,6]正在进行中,旨在阐明腹腔镜胃切除术与开腹胃切除术相比在手术结果,生存率和生活质量方面的益处。此外,由于手术技巧的提高,手术器械的进步以及过去20年的细致围手术期处理,胃癌患者胃切除术的总体发病率和死亡率均有所下降[7]。
然而,十二指肠残端渗漏仍然是胃切除术后致命的并发症。据报道,胃癌胃切除术后Billroth II或Roux-en-Y重建的十二指肠残端渗漏率为1.6%-5.0%[8]。根据最近的一项多中心研究,与开放式方法相比,腹腔镜方法增加了十二指肠残端发生的风险[9]。
迄今为止,胃癌患者在腹腔镜或开腹胃切除术后未进行前瞻性临床试验。作者以前报道了一种新的腹腔镜加强缝线技术(LARS),在十二指肠残端的钉线上使用带倒勾的缝线来预防十二指肠残端漏[10]。在这里,作者描述了一项前瞻性II期研究的结果,以评估该技术的安全性。
材料和方法
学习规划
根据作者的经验,这项研究所需的患者估计数为100,持续18个月,因为根据作者的经验,1195例患者中胃切除术后十二指肠残端的发生率为1.1%[11]。如果发生超过2例十二指肠残端漏出,作者计划停止研究。根据临床怀疑,来自引流管的液体的实验室检查结果或使用计算机断层扫描(CT)或瘘管造影的放射学检查结果来定义十二指肠残端渗漏。
纳入标准是组织学证实的胃腺癌,腹腔镜远端或全胃切除术和Billroth II或Roux-en-Y重建,患者年龄> 19岁。如果除了胆囊切除术之外,如果他们有既往腹部手术史,并且除了胆囊切除术之外需要联合腹部手术,则排除患者。胃出口梗阻或癌症侵犯幽门的患者也被排除在外。
主要终点是术后前30天内十二指肠残端瘘的发生率。次要终点是术后早期结果,直至出院。该研究是在东亚大学医院的机构审查委员会(IRB No. DAUHIRB-16-010)批准下进行的。所有患者在参与研究之前都提供了书面知情同意书。该研究在ClinicalTrials.gov(NCT03085199)注册。
手术技术
对于胃癌患者的腹腔镜胃切除术,使用5个套管针,而操作者在整个手术过程中站在患者右侧,如作者之前的报告[12]所述。在使用线性缝合器将十二指肠残端切割成约2cm长度之后,在十二指肠残端的钉线上从上部开始到下部。使用带倒钩的缝合线进行十二指肠残端内陷的连续缝合(图1)。对于十二指肠球部由于慢性溃疡或异位胰腺引起的短十二指肠残端的患者,使用带倒钩的缝合线放置2或3个间断缝合而没有十二指肠残端内陷(图2)。
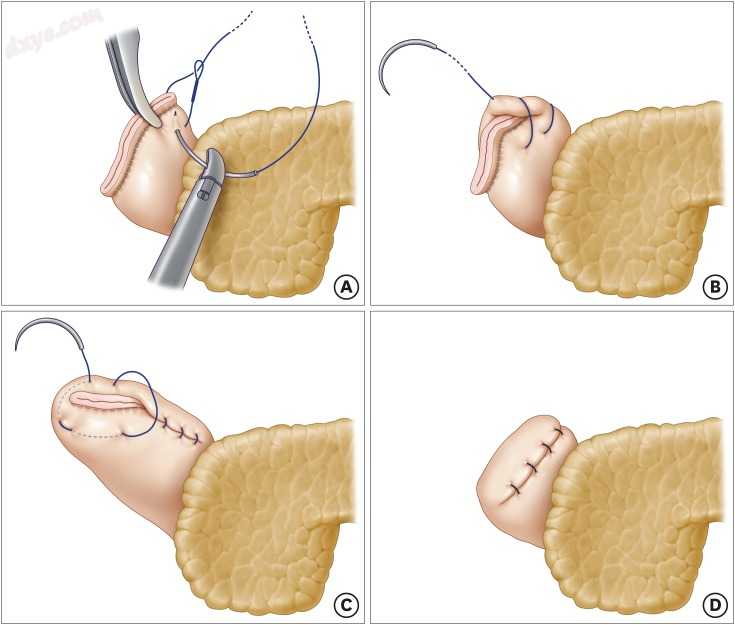
图1
连续LARS与内陷。 在十二指肠残端的上端,进行带倒刺缝合的三角形缝合线(A)。 然后,使钉线内陷的加强缝合线一直延续到十二指肠残端(B)的下端。 在下端,再次进行具有内陷的三角形缝合线(C)。 在内陷连续缝合结束后,将十二指肠残端钉线埋在带倒勾的缝线(D)下。
LARS =腹腔镜加强缝线。
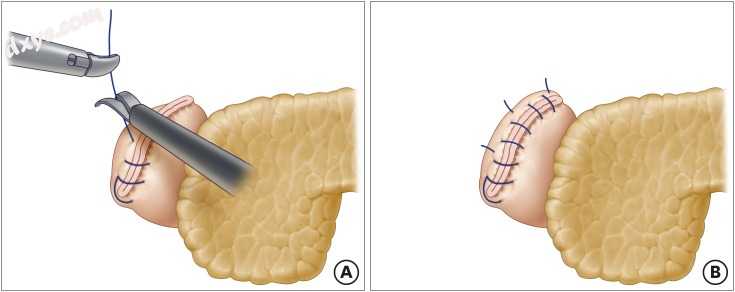
图2
没有内陷的LARS中断。从十二指肠残端的一端,使用倒刺缝线的间断缝合线进行2或3次以覆盖整个钉线。
LARS =腹腔镜加强缝线。
围手术期管理
所有患者均采用标准化术后方案常规管理如下:1)无鼻胃管插管或术前机械性肠道准备; 2)手术过程中胃内容物的极少量溢出; 3)注射预防性抗生素两次,术前30分钟和术后1小时; 4)使用一个封闭式排水管; 5)手术后一天啜饮水; 6)术后3天采用清液饮食; 7)在没有异常临床症状的情况下,在手术后6或7天出院。
所有操作均由M.C.执行。 Kim自2003年4月以来已经进行了> 1,500例腹腔镜胃切除术治疗胃癌。本研究所腹腔镜胃切除术治疗胃癌的指征低于术前阶段cT2或3N1M0。
结果
患者特征
在2016年2月至2017年3月期间,100名患者参加了该研究。有一例术后死亡,但99名患者按计划完成术后30天随访。这些患者的人口统计学和临床​​病理学特征总结在表1中。研究组由65名男性和35名女性组成,平均年龄(年)为62.3。在这些患者中,63例(63%)患有合并症,其中高血压和糖尿病最常见。大多数患者(n = 99)接受了Billroth II重建的腹腔镜远端胃大部切除术。在最终病理检查中,根据国际癌症控制联盟/美国癌症联合委员会(UICC / AJCC)肿瘤,淋巴结和转移,84名患者进入I期,14名患者进入II期,2名患者患有III期癌症。 (TNM)分类(第7版)。回收淋巴结(LN)的平均数量为38。
表格1
患者的人口统计学和临床病理学特征
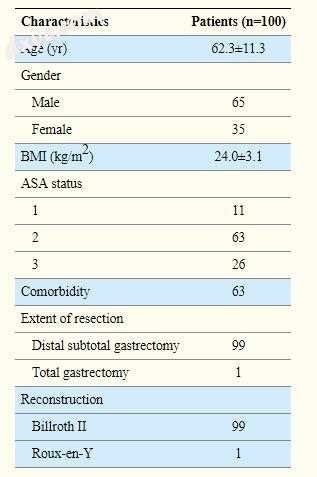
所有值均为标准偏差。
BMI =体重指数; ASA =美国麻醉医师协会; LN =淋巴结。
手术结果和手术并发症
在任何研究患者中均未观察到十二指肠残端渗漏。所有患者均接受D2 LN解剖,部分切除术。平均手术时间为145分钟,包括7.8分钟的平均LARS时间(图3)。在99名患者中成功进行了十二指肠残端内陷的LARS(表2)。并发症13例,其中一例再次行脾动脉破裂。根据Clavien-Dindo分类,只有3例患者出现IIIa级以上的并发症,术前27天患有特发性肺纤维化的80岁男性患者在术后27天死于肺功能衰竭(表3)。
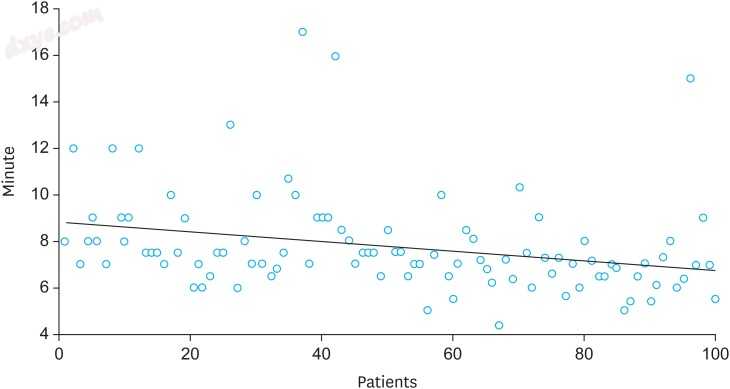
图3
LARS在100名患者中的手术时间。 LARS的平均时间是7.8分钟。平均值的95%置信区间为7.3674至8.2106。
LARS =腹腔镜加强缝线。
表2
手术结果
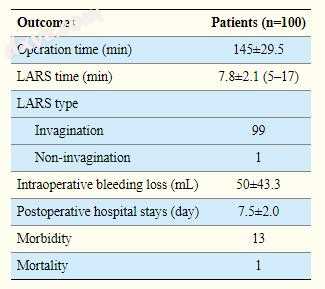
所有值均为标准偏差。
LARS =腹腔镜加强缝线。
表3
发病率和死亡率
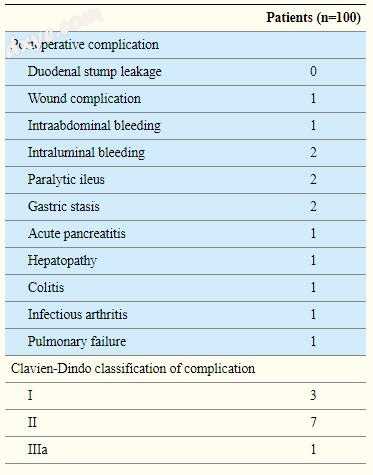
讨论
1992年,Kitano等人。 [13]首先介绍了胃癌的腹腔镜胃切除术;此后,韩国Laparo内镜胃肠外科研究(KLASS)小组通过积极的学习和教育,研讨会和国际学术交流,为胃癌患者腹腔镜胃切除术的快速适应做出了贡献[6]。为了提供胃癌腹腔镜胃切除术的一些临床证据,进行了一项回顾性多中心队列研究,包括3,053例胃癌患者。基于该数据库,发表了大量研究,以比较开腹与腹腔镜胃切除术的各个方面,如术后并发症[14],内镜下黏膜切除术后残留癌[15],晚期患者年龄[16],肥胖[17] ,复发[18]和生存[19,20]。随后,进行了2项最重要的随机对照试验,腹腔镜与开放式远端胃切除术,用于临床Ⅰ期胃癌:KLASS-01 [1]和局部晚期胃癌:KLASS-02 [4]。最近,在韩国,日本和中国,腹腔镜胃切除术通常用于治疗患有早期胃癌和晚期胃癌的患者。
然而,采用LN解剖的开腹胃切除术仍然是一项具有挑战性的手术,西方的发病率很高。 2项西方RCT [21,22]的发病率和死亡率分别为25%-46%和4%-13%。关于腹腔镜胃切除术,东部的2项大规模回顾性多中心试验[14,23]显示出14%的发病率和<1%的死亡率。西方腹腔镜胃切除术的几项小型回顾性单中心试验[24,25,26]分别报告了8%-23%的发病率和2.0%-3.5%的死亡率。东西方报告的术后发病率和死亡率的差异很可能归因于患者特征的差异以及胃癌的分期和发病率。尽管东部存在几个专门的高容量中心,据报道腹腔镜胃切除术后胃癌的吻合口漏发生率为1%-2%[14,24]。在吻合口漏的类型中,十二指肠残端泄漏可能是最严重的并发症,因为即将发生败血症或死亡,尽管十二指肠残端再次进行再次手术。
患者年龄,合并症,营养状况,慢性溃疡或十二指肠球部异位胰腺,癌症侵犯幽门或胃出口梗阻可被认为是胃切除术后十二指肠残端漏出的危险因素[8,9]。此外,建议在十二指肠周围采用精确细致的手术技术,以防止腹腔镜胃切除术中十二指肠,胰腺和血管的热损伤。外科医生以前对几种加强方法感兴趣,这些方法用于预防经历袖状胃切除术的病态肥胖患者的主要线路渗漏。用于钉线的增强方法包括可吸收膜或牛心包的各种应用,以及在钉线上缝合。在这些方法中,使用可吸收膜或在缝合线上进行加固后,在钉线上加固后实现了最低的渗漏率[27]。根据系统评价和大型回顾性研究[8,28],十二指肠残端保守治疗被确定为首选治疗方案,最终与经皮引流或经皮经肝胆管引流术(PTBD)相关[29]。对于严重病例或对保守治疗无效的患者,建议进行再次探查。
切割十二指肠后加固缝合钉线通常用于预防接受开腹手术的患者的十二指肠残端渗漏。 2016年7月至2017年1月,作者研究所在连续62例患者中开发并建立了十二指肠残端用于胃癌腹腔镜胃切除术的十二指肠残端钉线[10]。随后,计划进行当前的前瞻性II期研究,以评估100名患者的LARS安全性。使用倒钩缝合的十二指肠残端的主要线上的LARS包括内陷和非内陷类型。当切割后十二指肠残端长度<1 cm时,选择非内陷LARS。在本研究中,没有发生任何与LARS相关的术中或术后并发症。
根据这项前瞻性II期研究的结果,LARS可以在短期手术期间安全地进行,而不会发生十二指肠残端渗漏。需要一项随机前瞻性对照试验来证实LARS与非LARS相比的手术益处。
参考:
Laparoscopic Reinforcement Suture (LARS) on Staple Line of Duodenal Stump Using Barbed Suture in Laparoscopic Gastrectomy for Gastric Cancer: a Prospective Single Arm Phase II Study
1. Kim W, Kim HH, Han SU, Kim MC, Hyung WJ, Ryu SW, et al. Decreased morbidity of laparoscopic distal gastrectomy compared with open distal gastrectomy for stage I gastric cancer: short-term outcomes from a multicenter randomized controlled trial (KLASS-01) Ann Surg. 2016;263:28–35. [PubMed]
2. Hiki N, Katai H, Mizusawa J, Nakamura K, Nakamori M, Yoshikawa T, et al. Long-term outcomes of laparoscopy-assisted distal gastrectomy with suprapancreatic nodal dissection for clinical stage I gastric cancer: a multicenter phase II trial (JCOG0703) Gastric Cancer. 2017 doi: 10.1007/s10120-016-0687-0. [In print] [PubMed] [CrossRef]
3. Hu Y, Huang C, Sun Y, Su X, Cao H, Hu J, et al. Morbidity and mortality of laparoscopic versus open D2 distal gastrectomy for advanced gastric cancer: a randomized controlled trial. J Clin Oncol. 2016;34:1350–1357. [PubMed]
4. Hur H, Lee HY, Lee HJ, Kim MC, Hyung WJ, Park YK, et al. Efficacy of laparoscopic subtotal gastrectomy with D2 lymphadenectomy for locally advanced gastric cancer: the protocol of the KLASS-02 multicenter randomized controlled clinical trial. BMC Cancer. 2015;15:355. [PMC free article] [PubMed]
5. Park JY, Kim YW, Ryu KW, Nam BH, Lee YJ, Jeong SH, et al. Assessment of laparoscopic stomach preserving surgery with sentinel basin dissection versus standard gastrectomy with lymphadenectomy in early gastric cancer-a multicenter randomized phase III clinical trial (SENORITA trial) protocol. BMC Cancer. 2016;16:340. [PMC free article] [PubMed]
6. Kim KH, Kim SH, Kim MC. How much progress has been made in minimally invasive surgery for gastric cancer in Korea?: a viewpoint from Korean prospective clinical trials. Medicine (Baltimore) 2014;93:e233 [PMC free article] [PubMed]
7. Hyung WJ, Kim SS, Choi WH, Cheong JH, Choi SH, Kim CB, et al. Changes in treatment outcomes of gastric cancer surgery over 45 years at a single institution. Yonsei Med J. 2008;49:409–415. [PMC free article] [PubMed]
8. Aurello P, Sirimarco D, Magistri P, Petrucciani N, Berardi G, Amato S, et al. Management of duodenal stump fistula after gastrectomy for gastric cancer: systematic review. World J Gastroenterol. 2015;21:7571–7576. [PMC free article] [PubMed]
9. Cozzaglio L, Giovenzana M, Biffi R, Cobianchi L, Coniglio A, Framarini M, et al. Surgical management of duodenal stump fistula after elective gastrectomy for malignancy: an Italian retrospective multicenter study. Gastric Cancer. 2016;19:273–279. [PubMed]
10. Kim MC. Laparoscopic reinforcement suture of duodenal stump using barbed suture during laparoscopic gastrectomy for gastric cancer: preliminary results in consecutive 62 patients. Ann Laparosc Endosc Surg. 2017;2:28.
11. Kim KH, Kim MC, Jung GJ. Risk factors for duodenal stump leakage after gastrectomy for gastric cancer and management technique of stump leakage. Hepatogastroenterology. 2014;61:1446–1453. [PubMed]
12. Kim MC, Choi HJ, Jung GJ, Kim HH. Techniques and complications of laparoscopy-assisted distal gastrectomy (LADG) for gastric cancer. Eur J Surg Oncol. 2007;33:700–705. [PubMed]
13. Kitano S, Iso Y, Moriyama M, Sugimachi K. Laparoscopy-assisted Billroth I gastrectomy. Surg Laparosc Endosc. 1994;4:146–148. [PubMed]
14. Kim MC, Kim W, Kim HH, Ryu SW, Ryu SY, Song KY, et al. Risk factors associated with complication following laparoscopy-assisted gastrectomy for gastric cancer: a large-scale Korean multicenter study. Ann Surg Oncol. 2008;15:2692–2700. [PubMed]
15. Song KY, Hyung WJ, Kim HH, Han SU, Cho GS, Ryu SW, et al. Is gastrectomy mandatory for all residual or recurrent gastric cancer following endoscopic resection? A large-scale Korean multi-center study. J Surg Oncol. 2008;98:6–10. [PubMed]
16. Cho GS, Kim W, Kim HH, Ryu SW, Kim MC, Ryu SY. Multicentre study of the safety of laparoscopic subtotal gastrectomy for gastric cancer in the elderly. Br J Surg. 2009;96:1437–1442. [PubMed]
17. Lee HJ, Kim HH, Kim MC, Ryu SY, Kim W, Song KY, et al. The impact of a high body mass index on laparoscopy assisted gastrectomy for gastric cancer. Surg Endosc. 2009;23:2473–2479. [PubMed]
18. Song J, Lee HJ, Cho GS, Han SU, Kim MC, Ryu SW, et al. Recurrence following laparoscopy-assisted gastrectomy for gastric cancer: a multicenter retrospective analysis of 1,417 patients. Ann Surg Oncol. 2010;17:1777–1786. [PubMed]
19. Kim HH, Han SU, Kim MC, Hyung WJ, Kim W, Lee HJ, et al. Long-term results of laparoscopic gastrectomy for gastric cancer: a large-scale case-control and case-matched Korean multicenter study. J Clin Oncol. 2014;32:627–633. [PubMed]
20. Kim HH, Hyung WJ, Cho GS, Kim MC, Han SU, Kim W, et al. Morbidity and mortality of laparoscopic gastrectomy versus open gastrectomy for gastric cancer: an interim report--a phase III multicenter, prospective, randomized Trial (KLASS Trial) Ann Surg. 2010;251:417–420. [PubMed]
21. Bonenkamp JJ, Hermans J, Sasako M, van de Velde CJ, Welvaart K, Songun I, et al. Extended lymph-node dissection for gastric cancer. N Engl J Med. 1999;340:908–914. [PubMed]
22. Cuschieri A, Weeden S, Fielding J, Bancewicz J, Craven J, Joypaul V, et al. Patient survival after D1 and D2 resections for gastric cancer: long-term results of the MRC randomized surgical trial. Br J Cancer. 1999;79:1522–1530. [PMC free article] [PubMed]
23. Kitano S, Shiraishi N, Uyama I, Sugihara K, Tanigawa N Japanese Laparoscopic Surgery Study Group. A multicenter study on oncologic outcome of laparoscopic gastrectomy for early cancer in Japan. Ann Surg. 2007;245:68–72. [PMC free article] [PubMed]
24. Pugliese R, Maggioni D, Sansonna F, Scandroglio I, Ferrari GC, Di Lernia S, et al. Total and subtotal laparoscopic gastrectomy for adenocarcinoma. Surg Endosc. 2007;21:21–27. [PubMed]
25. Strong VE, Devaud N, Allen PJ, Gonen M, Brennan MF, Coit D. Laparoscopic versus open subtotal gastrectomy for adenocarcinoma: a case-control study. Ann Surg Oncol. 2009;16:1507–1513. [PubMed]
26. Allieta R, Nardi M, Jr, Brachet-Contul R, Millo P, Fabozzi M, Cornaglia S, et al. Laparoscopic gastrectomy for treatment of advanced gastric cancer: preliminary experience on 38 cases. Minerva Chir. 2009;64:445–456. [PubMed]
27. Gagner M, Buchwald JN. Comparison of laparoscopic sleeve gastrectomy leak rates in four staple-line reinforcement options: a systematic review. Surg Obes Relat Dis. 2014;10:713–723. [PubMed]
28. Ali BI, Park CH, Song KY. Outcomes of non-operative treatment for duodenal stump leakage after gastrectomy in patients with gastric cancer. J Gastric Cancer. 2016;16:28–33. [PMC free article] [PubMed]
29. Kim KH, Lee HB, Kim SH, Kim MC, Jung GJ. Role of percutaneous transhepatic biliary drainage in patients with complications after gastrectomy. Int Surg. 2015;101:78–83. [PubMed] |


