马上注册,结交更多好友,享用更多功能,让你轻松玩转社区。
您需要 登录 才可以下载或查看,没有账号?注册
×
概要
颈部瘢痕挛缩可严重和负面地影响咀嚼,发声或呼吸的功能,并导致颈部疼痛和美学问题。当然,最好的方法是通过非手术治疗来避免这种挛缩,例如使用生长因子。基本成纤维细胞生长因子在临床上已被证实可减少瘢痕形成和改善愈合。颈部挛缩有许多重建方法,特别是当部分颈部的病变相对有限时。然而,非常严重且完全的周围瘢痕挛缩需要大量重建。薄腹股沟皮瓣是其中一个答案,与组织纹理很好地匹配,并保持灵活性。即使由于复苏首次大面积烧伤和延迟重建,腹股沟区域也得到了很好的保护,并且可以通过浅表旋髂动脉和浅表性上腹动脉的双重血管系统安全地采集,与该区域的穿支皮瓣相比,这保证了更高的可靠性。 。更严格和严格形式的颈部烧伤瘢痕挛缩是辐射的后遗症。辐射烧伤或辐射损伤可能正在发展并且难以愈合。当周围组织软化并且可以加速伤口愈合时,脂肪来源的干细胞可以逆转瘢痕挛缩。在这篇综述中,总结了不同类型的颈部烧伤瘢痕挛缩和重建方法,包括创新使用bFGF和ADSCs治疗难以治愈的伤口愈合和瘢痕挛缩。
关键词:颈部瘢痕挛缩,解剖部位,预防,严重瘢痕挛缩,腹股沟皮瓣,放射损伤,脂肪干细胞
背景
颈部挛缩可能导致功能严重受损和美观恶化。儿童可能正在逐渐恶化并且随着他们的成长而进一步丧失功能,并且在受伤时愈合明显延迟。最好的方法是通过早期治疗和缓解来避免严重烧伤颈部瘢痕挛缩。一旦发生严重的颈部烧伤瘢痕挛缩,功能和美学的恢复非常困难。
通常,颈部烧伤瘢痕挛缩由解剖位置和烧伤原因进行细分。
在多次手术失败的情况下,提出了重建挛缩,预防挛缩和新型干细胞治疗的详细手术方法。
在颈部烧伤和挛缩的治疗中讨论了使用细致的薄腹股沟皮瓣,生长因子的早期干预和患者自身干细胞的各种方法。
评论
颈部瘢痕挛缩的类型和原因
前颈部挛缩
前颈部包含主要的功能性器官组织,例如甲状腺,颈动脉,颈静脉血管和气道。在一系列11例,年龄为5至14岁的患者中,对烧伤后颈部挛缩进行了回顾,试图开发一种用局部瘢痕 - 筋膜皮瓣重建的新方法[1]。
挛缩的严重程度分为三个等级:(1)轻度至中度,颈椎角度平滑,颈部受限,但下颌与胸骨角度正常; (2)严重,即下颌角,下颌与下颌之间的距离缩短; (3)融合,闭塞的下颌柄和下颌融合的下巴。手术时间从受伤后1至5年不等。消除挛缩和恢复颈部轮廓是评估因素。消除长而复杂的外科手术的好处导致挛缩疗法的更好结果。
两个梯形瘢痕 - 筋膜操作前颈的所有组成部分,包括疤痕,脂肪,颈阔肌和深筋膜,使长度从100%延长至200%。它没有挛缩,颈椎角度恢复。所有案例都获得了头部的全部功能扩展。皮瓣正在生长,而下颌下和锁骨上方严重挛缩的皮肤移植减少很少。疤痕释放过程可能会比预先计划的更加扩大[2],并且烧伤挛缩的患者本身需要清醒光纤插管,使用插管喉罩气道,插入无神经肌肉阻滞剂,插入神经肌肉阻滞剂在测试通过面罩通气的能力,在局部麻醉和氯胺酮下预诱导颈部瘢痕释放,或镇静后直接喉镜检查[3]。
外侧颈部挛缩
在对颈外侧挛缩进行回顾的研究中,一组21例外侧颈部挛缩患者,10名男性和11名女性,年龄为6至43岁,在烧伤后1至3年进行手术,并对挛缩的解剖和原因进行了调查,以确定用本地皮瓣治疗的类型。手术结果用运动和轮廓的功能范围进行评估。作者得出结论,任何挛缩都是由折叠产生的,在其中有过多表面并且相邻表面和颈前表面的区域可能是供体部位。因此,应考虑局部皮瓣技术[4]。在局部皮瓣中,脂肪或脂肪瘢痕梯形皮瓣坚持优于其他局部皮瓣,如VY皮瓣,Z形整形术,VY整形术中的三角皮瓣,或游离皮瓣或蒂皮瓣[5-7],当组织是表面过量,使过多的组织可用于疤痕释放。然而,当它受到限制时,通常不考虑包括梯形皮瓣在内的局部组织皮瓣,无论其类型如何,而且与颈前挛缩相比,侧颈收缩的频率和严重程度[4]。
严重烧伤并烧伤颈部瘢痕挛缩
经常观察到紧急挽救生命的大面积烧伤治疗后严重烧伤瘢痕挛缩。关于初始病变的深度和程度以及随后的继发效应,有几种类型的颈部挛缩,但在最严重的情况下,颈部的运动范围受到很大限制,并且烧伤瘢痕挛缩扩展到两者。侧面以及前侧,特别是在资源有限的低收入和中等收入国家[8]。
辐射损伤后颈部挛缩
放射性烧伤引起的瘢痕挛缩尤其令人担忧。放射性皮炎或放射性损伤可被认为是烧伤后果的严重形式[9,10]。放射性皮炎分为两个阶段。在急性期,它开始出现红肿或红斑,肿胀或水肿,以及色素沉着。据报道,皮肤敏感性和紧张性增加,可能导致晚期(慢性)纤维化[11]。在更大剂量下,患者可能伴随干燥,瘙痒和皮肤脱落而发生干燥脱屑。观察到电离辐射剂量的更多增加,更常见的是潮湿的脱屑。
事故发生后数月至数年,出现了慢性期[12]。在慢性期,由于黑素细胞 - 黑素体所在的皮肤上皮连接处的损伤,从水肿皮肤到低色素沉着和色素沉着过度发生变化。它取决于主观和治疗相关的方面,随着时间的推移延长或正常化[13]。
纤维化组织变化和过度毛细血管形成,毛细血管扩张,通常由慢性放射性损伤引起,伴有溃疡,皮肤撕裂,组织萎缩或萎缩以及随后的运动,疼痛和血栓形成阻塞的限制[14]。该组织的特征在于愈合的明显破坏和对感染的易感性增加。
电离辐射可以渗透到更深的组织,如骨骼,软骨,肌肉,肌腱或韧带。近来,利用电离辐射来治疗恶性肿瘤,除了医疗辐射之外,还存在一些关于“辐射”威胁的问题,例如核电站暴露,工作暴露于辐射和武器。
治疗方法
促进伤口愈合更快和使用bFGF
适当的治疗和术后护理将在烧伤疤痕治疗中产生有利的功能和美学。使用生长因子如碱性成纤维细胞生长因子(bFGF)可加速儿童和成人的烧伤创面愈合[15-19],并将疤痕形成减至最少。鉴于功能重建,bFGF的理想持续时间最长为3周[3]。 bFGF可有效减少皮肤成分如深层真皮成分[15,16,19]的疤痕,但在分期手术中使用时也能带来更好的疤痕质量;人工真皮先于伤口床,通过主观和客观参数和测量证实[20]。在辐射损伤中,当局部给予bFGF可以逆转增加的易感性和皮瓣存活时组织可能受损[21]。局部皮下注射bFGF可改善并维持皮肤和软组织中立即照射后的组织活力[22]。适当的颈部衣服和固定装置以及早期bFGF治疗可以有助于更好的结果,并且可以是烧伤颈部挛缩的候选预防方法。
使用bFGF的临床病例
一名36岁的女性被开水烧过她的衬衫。烧伤到达颈部的前侧和外侧表面。从第2天开始,在深部皮肤烧伤区域开始bFGF,并尽可能地去除焦痂。到第21天,中心区域坏死被划分并且清创和15/1000-in。移植了大腿外侧的分层皮肤移植物(图1)。术后10个月,虽然“画框”现象略有不足,但颈部的功能,旋转,最大伸展和屈曲,以及较少的瘢痕挛缩和与颈部颜色匹配的美学是可以接受的(图1) )。
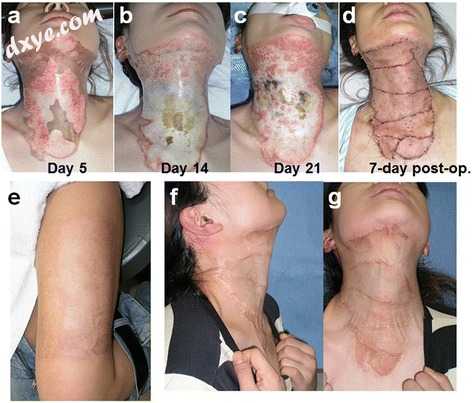
图1
使用bFGF的临床病例。一名36岁的女性在穿着衣服时意外地灼伤了她的脖子。 bFGF从第2天开始至第21天(a,b,c)。去除焦痂和15/1000-in。将分层厚度的皮肤移植物应用于颈部(d)。供体部位发病率最低(e),颈部运动得以保留(f),尽管观察到一些“画框”轻微疤痕(g)
颈部挛缩的区域策略
严重的颈部烧伤挛缩会恶化运动范围和美容[8]。已经尝试了许多外科技术并且未能定义治疗指南或算法。回顾24例患者,术后第3个月,软组织颈 - 下颌(CM)角度明显减小,而骨性CM和完全伸展和完全屈曲所定义的动态角度均显著增加。软组织CM角度被认为是静态标记,并受多种因素的影响,并且可能是陷入蒙面毁容的凹坑。无论是描述性的还是定量的,CM角度对于正常和颈部挛缩都是一个非常重要的标志[23-27],一旦受损,功能和美学都很突出。为了获得更好的结果,颈阔肌操作被强调以实现近端肌瓣,其返回并稳定到下颌骨的边界,因为这能够增强颏区域,使软组织CM角度成角度,并且避免复发挛缩另外,可以将下部肌肉向下转向以在远端颈胸交界处的瘢痕区域表面并促进皮肤移植。
用于严重和延长瘢痕挛缩的薄且可塑性皮瓣重建
非常重要的是用足够的量,足够的可塑性以及颜色和纹理匹配的组织来代替导致瘢痕挛缩的缺陷。当挛缩限于中度至中度时,选择邻近组织扩张或类似组织供体 - 瓣部皮瓣重建[28-31]。
在这种严重且周围完整的圆周颈部瘢痕挛缩中,计划从腹股沟处游离(血管化)皮瓣。游离腹股沟皮瓣非常柔软,体积较小,因此可以根据缺损进行调整,并且很容易与周围组织相匹配,即使在严重和广泛的烧伤中也经常作为“供体”部位保存,它也被认为具有非常低的供体部位发病率[ 32]并且易于调节到频繁的活动关节,如头部和颈部[33]。此外,与穿支皮瓣相比,该皮瓣的优越性在于两个解剖学上稳定的蒂可以是蒂血管的候选者,即浅表旋髂动脉(SCIA)和浅表性上腹动脉(SEA)的浅表分支。在除了血管,SCIA或SEA,树干之外的四分之三区域中,在切断营养血管之前或之后,可以在显微镜下针对“薄腹股沟皮瓣”定制腹股沟皮瓣。可以采集5×12cm至13×30cm的皮瓣并使皮瓣脱脂以使其更具延展性,可以在皮瓣的内侧半部分和“短蒂”方法中使用,特别是当分离SCIA和SEA(图2)。与首先识别穿孔营养瓣的穿孔瓣相比[34]并因此限制更复杂和更大的组织缺损覆盖,薄的腹股沟皮瓣仍然可用于瘢痕挛缩后释放[35]。
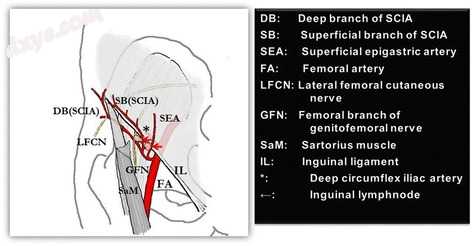
图2
腹股沟区血管解剖。 “腹股沟皮瓣”可以通过髂浅动脉和浅上腹动脉的双重脉管系统得到保证
在严重和广泛的烧伤中,这可能会延迟保持颈部活动范围和瘢痕美学的适当治疗,腹股沟区域几乎总是完整的,可以作为功能和美学重建的候选者。
腹股沟皮瓣薄的临床病例
一名40岁的女性患有严重的颈部运动受限和与咀嚼有关的口腔运动,有时还流口水,因为下唇由于外翻而难以闭合。烧伤三年后,为了去除下唇和下颌骨中的瘢痕组织,改善CM角度,并取代前颈部区域,进行清创,直至进行面部表情和颈阔肌,并将伤口覆盖一个10×25厘米宽的脱脂(薄)腹股沟皮瓣血管化SCIA和SEA脉管系统。在术后24个月,咀嚼平稳改善,未观察到流涎。颜色和纹理均与邻近组织相匹配,颈部运动和下颌区域的形状恢复正常。皮瓣重建后面部表情变得更容易(图3)。
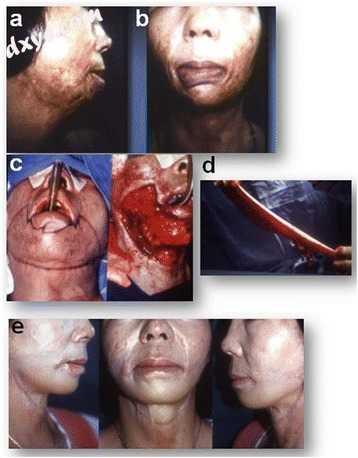
图3
腹股沟皮瓣薄的临床病例。 一名40岁的女性患上严重的下颌骨和颈部瘢痕挛缩(a,b)。 患者患有流口水和下唇睑外翻。 包括下唇和颈部在内的疤痕释放被10×25厘米的腹股沟皮瓣覆盖,缺陷(c,d),颈部功能和外观在24个月时改善(e)
一名39岁女性患有火焰烧伤导致前下部和下部全长颈部表面出现大面积烧伤瘢痕挛缩。 在瘢痕释放后,一个13×30厘米的脱脂薄腹股沟皮瓣被插入以填充颈 - 下颌区域和四分之三的颈。 术后24个月,颈部形态反映了甲状软骨和包括胸锁乳突肌在内的肌肉。 下唇外翻更正常地逆转,唇部无力恢复(图4)。
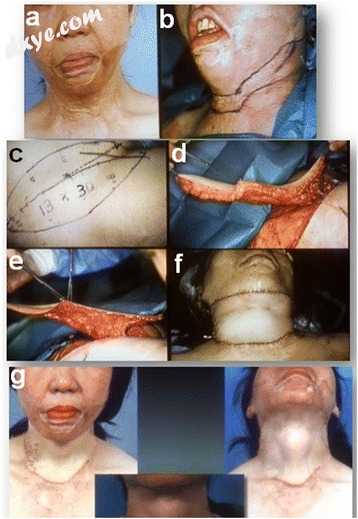
图4
腹股沟皮瓣薄的临床病例。一名39岁的女性患有严重的全周围颈部瘢痕挛缩(a,b)。颈部运动受损以及嘴唇无能导致她的生活质量受到严重限制。在瘢痕释放后,设置13×30cm脱脂薄腹股沟皮瓣(c,d,e)以填充颈 - 下颌区域和颈的四分之三(f)。术后24个月,颈部形态反映了甲状软骨和肌肉,包括胸锁乳突肌(g)。下唇外翻更正常地逆转,唇部无力恢复
辐射损伤的慢性后遗症
由于预防非常困难,并且缓解在当前的临床模式中不太理想[36],因此新型疗法经过创新和临床测试。其中,骨髓来源的干细胞(BMDSCs)似乎首先在组织再生中发挥不可或缺的作用。除骨髓来源外,间充质细胞能够与其他祖细胞如内皮祖细胞和髓单核细胞一起导致愈合过程。在体外,由于基质细胞衍生因子的趋化作用和CXCR4的过量产生,证实这些细胞被吸引到辐射损伤部位[37,38]。髓单核细胞可用于主要的BMDC定位于受照射的组织中并通过血管生成和营养因子的作用刺激血管再生和修复。包括BMDCs和脂肪干细胞(ADSCs)在内的间充质干细胞成功地参与了困难和难治性临床应用的外科治疗,并且由于细胞来源的丰富性和多样性,人ADSCs有利于直接使用[39]和已被证明是加速伤口愈合过程的有效治疗方法[40]。 ADSCs是多能细胞,能够促进血管生成,分泌和与生化因子和信使相互作用,并在伤口愈合的再上皮化阶段刺激真皮成纤维细胞增殖[41]。
此外,这些细胞可能从炎症和调节级联开始,并导致缺血再灌注损伤[42]。
即使骨髓和脂肪来源的干细胞类型之间的转录和蛋白质组水平存在细胞特异性差异,根据它们的组织起源和向脂肪形成,成骨和软骨细胞分化的过程,体外和体内ADSC显示与骨髓来源的干细胞分化为软骨细胞/成骨细胞相同的能力,舒适作为有希望的再生细胞的两种细胞来源的状态[43]。 ADSC更容易采集,更丰富,可以远离辐射场[40]。
ADSCs治疗慢性放射损伤的临床病例
一名52岁的女性患有顽固性慢性放射性伤口,这限制了她的颈部运动,运动范围为130°。患者接受了多次手术,包括皮肤移植,分期人工真皮和皮肤移植,局部皮瓣和游离皮瓣。伤口短时间内关闭,但在几个月内总是复发。颈部运动的主观限制从未恢复。通过吸脂手术采集约350ml脂肪组织。采集物含有4.1×107脂肪来源的细胞,包括ADSC。进行了细致的急剧清创,通过超声波识别颈动脉避免损伤,由于放射和先前手术后的挛缩而更加向前定位。缺损尺寸为25×17mm,部分深入到暴露的左侧甲状软骨。将具有ADSC的细胞注射到清创伤口边缘和伤口基部。在75天内,伤口愈合,颈部向前运动得到改善,在6个月时,注射的皮下病变仍保持其柔软质地,并显示出厚厚的血管化软组织,运动范围改善至165°(图.5)。
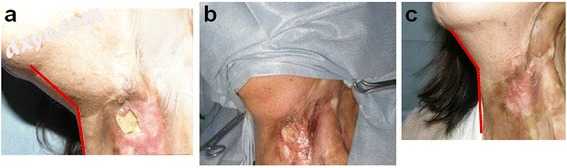
图5
ADSCs治疗慢性放射损伤的临床病例。一名52岁的女性患有顽固性慢性放射性伤口,这限制了她的颈部运动,运动范围为130°(a)。缺损尺寸为25×17mm,并且部分深入到暴露的左侧甲状软骨(b)。处理具有脂肪来源干细胞的非培养细胞,然后注射到清创伤口边缘和伤口基部。在75天内,伤口愈合,颈部向前运动得到改善,在6个月时,注射的皮下病变仍保持其柔软质地,并显示出厚厚的血管化软组织,运动范围改善至165°(c )
复原
颈部压力的定位和施加与颈部重建的需要显著相关。皮肤移植后颈部的延迟压力和定位可导致更早且更频繁地需要颈部重建[44]。然而,可塑性和广泛的皮瓣可以比皮肤移植更有效地恢复,并且可以导致更好的结果。
讨论
颈部是呼吸,咀嚼,语音和内分泌腺体的主要器官的组成部分,如甲状腺和甲状旁腺以及唾液腺。
面部表情也可以在面部和颈部的面部肌肉中确定。一旦发生儿科期的损伤,随后对运动,生长和微笑的影响在精神病学缺陷和客观损伤方面都是巨大的[45-47]。在成人大面积烧伤时,颈部可能不太注意,因为初始治疗尝试复苏和更容易的区域,这可能导致延迟治疗开始并导致严重挛缩,尽管发病率低于四肢其他关节[48] ]。最重要的策略是通过及时的细致治疗来避免严重的颈部挛缩后遗症。在部分厚度烧伤中,生长因子治疗导致伤口愈合更快,瘢痕形成更少,因此伤口愈合质量更好[15,16,19]。
在严重的颈部挛缩中,提出了许多重建选项,包括局部[1,2,4-7]和游离皮瓣[24]以及组织扩张的组合。然而,在非常严重的情况下,很难找到供体部位。腹股沟区域是其中一种选择,因为它体积大,可塑性强,可调节受体疤痕释放缺陷,并且通过浅表旋髂血管和浅表上腹血管使“双重”血管营养更安全[32,33]。
辐射损伤可逐渐且迅速地改变组织结构并可导致纤维化。从放射性皮炎开始到由纤维化的血管化组织包围的难治性伤口,放射性损伤可导致最难烧伤后遗症之一[39-41]。许多疗法都试图控制放射性损伤,ADSCs被认为是细胞疗法的一个很好的候选者,因为它们是多能的,能够促进血管生成,分泌和与生化因子和信使相互作用,并在再上皮化阶段刺激皮肤成纤维细胞增殖。伤口愈合[39]。
在慢性放射性损伤后伴有溃疡的颈部挛缩中,ADSC治疗改善了瘢痕挛缩以及伤口愈合[40,41]。
结论
虽然讨论了许多关于颈部烧伤瘢痕挛缩重建的建议,但严重的全周挛缩病例尚未阐明。
即使在严重烧伤的情况下,腹股沟区域也是主要保留的,并且腹股沟皮瓣变细,其营养血管由浅表旋髂髂和浅表上腹血管加倍,是完全收缩颈部瘢痕覆盖的良好候选者。
辐射损伤可能导致长期顽固性伤口的纤维化组织改变。在某些情况下,患者自身脂肪来源的干细胞治疗辐射损伤引起的颈部疤痕可以在单次细胞治疗后数周内愈合,颈部活动范围非常柔软和灵活。
参考:
The neck burn scar contracture: a concept of effective treatment
1. Grishkevich VM, Grishkevich M, Menzul V. Postburn neck anterior contracture treatment in children with scar-fascial local trapezoid flaps: a new approach. J Burn Care Res. 2015;36:e112–9. doi: 10.1097/BCR.0000000000000118. [PubMed] [CrossRef] [Google Scholar]
2. Ulrich D, Fuchs P, Pallua N. Preexpanded vertical trapezius musculocutaneous flap for reconstruction of a severe neck contracture after burn injury. J Burn Care Res. 2008;29:386–9. doi: 10.1097/BCR.0b013e31816677d9. [PubMed] [CrossRef] [Google Scholar]
3. Prakash S, Mullick P. Airway management in patients with burn contractures of the neck. Burns. 2015;41:1627–35. doi: 10.1016/j.burns.2015.03.011. [PubMed] [CrossRef] [Google Scholar]
4. Grishkevich VM, Grishkevich M. Postburn neck lateral contracture anatomy and treatment: a new approach. J Burn Care Res. 2015;36:e294–9. doi: 10.1097/BCR.0000000000000205. [PubMed] [CrossRef] [Google Scholar]
5. Ascar I. Double reverse V-Y plasty in postburn scar contractures: a new modification of V-Y plasty. Burns. 2003;29:721–5. doi: 10.1016/S0305-4179(03)00084-6. [PubMed] [CrossRef] [Google Scholar]
6. Tan O, Atik B, Ergen D. A new method in the treatment of postburn scar contractures: double opposing V-Y-Z plasty. Burns. 2006;32:499–503. doi: 10.1016/j.burns.2005.11.016. [PubMed] [CrossRef] [Google Scholar]
7. Emsen LM. A new method in the treatment of postburn and posttraumatic scar contractures: double opposing Z and V- (K-M-N) plasty. Can J Plast Surg. 2010;18:e20–6. doi: 10.1177/229255031001800202. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
8. Cai L, Puri V, Dangol MK, Mannan II, Khundkar SH, Le Thua TH, et al. The Stanford-ReSurge burn scar contracture scale for neck: development and initial validation for burn scar contracture. Plast Reconstr Surg. 2016;138:896e–902. [PubMed]
9. Ran XZ, Shi CM, Zheng HE, Su YP, Cheng TM. Experimental research on the management of combined radiation-burn injury in China. Radiat Res. 2011;175:382–9. doi: 10.1667/RR2198.1. [PubMed] [CrossRef] [Google Scholar]
10. Waghmare CM. Radiation burn-from mechanism to management. Burns. 2013;39:212–9. doi: 10.1016/j.burns.2012.09.012. [PubMed] [CrossRef] [Google Scholar]
11. Nevens D, Duprez F, Daisne JF, Laenen A, De Neve W, Nuyts S. Radiotherapy induced dermatitis is a strong predictor for late fibrosis in head and neck cancer. The development of a predictive model for late fibrosis. Radiother Oncol. S0167-8140(16)34277-3, 2016. [PubMed]
12. Salvo N, Barnes E, van Draanen J, Stacey E, Mitera G, Breen D, et al. Prophylaxis and management of acute radiation-induced skin reactions: a systematic review of the literature. Curr Oncol. 2010;17:94-112. [PMC free article] [PubMed]
13. Hymes SR, Strom EA, Fife C. Radiation dermatitis: clinical presentation, pathophysiology, and treatment 2006. J Am Acad Dermatol. 2006;54:28–46. doi: 10.1016/j.jaad.2005.08.054. [PubMed] [CrossRef] [Google Scholar]
14. Amber KT, Shiman MI, Badiavas EV. The use of antioxidants in radiotherapy-induced skin toxicity. Integr Cancer Ther. 2014;13:38–45. doi: 10.1177/1534735413490235. [PubMed] [CrossRef] [Google Scholar]
15. Akita S, Akino K, Imaizumi T, Tanaka K, Anraku K, Yano H, et al. The quality of pediatric burn scars is improved by early administration of basic fibroblast growth factor. J Burn Care Res. 2006;27:333–8. [PubMed]
16. Hayashida K, Akita S. Quality of pediatric second-degree burn wound scars following the application of basic fibroblast growth factor: results of a randomized, controlled pilot study. Ostomy Wound Manage. 2012;58:32–6. [PubMed] [Google Scholar]
17. Hayashida K, Fujioka M, Morooka S, Saijo H, Akita S. Effectiveness of basic fibroblast growth factor for pediatric hand burns. J Tissue Viability. 2016;25:220–4. doi: 10.1016/j.jtv.2016.06.007. [PubMed] [CrossRef] [Google Scholar]
18. Akita S, Akino K, Imaizumi T, Hirano A. A basic fibroblast growth factor improved the quality of skin grafting in burn patients. Burns. 2005;31:855–8. doi: 10.1016/j.burns.2005.04.008. [PubMed] [CrossRef] [Google Scholar]
19. Akita S, Akino K, Imaizumi T, Hirano A. Basic fibroblast growth factor accelerates and improves second-degree burn wound healing. Wound Repair Regen. 2008;16:635–41. doi: 10.1111/j.1524-475X.2008.00414.x. [PubMed] [CrossRef] [Google Scholar]
20. Akita S, Akino K, Tanaka K, Anraku K, Hirano A. A basic fibroblast growth factor improves lower extremity wound healing with a porcine-derived skin substitute. J Trauma. 2008;64:809–15. doi: 10.1097/TA.0b013e31802c8247. [PubMed] [CrossRef] [Google Scholar]
21. Hom DB, Unger GM, Pernell KJ, Manivel JC. Improving surgical wound healing with basic fibroblast growth factor after radiation. Laryngoscope. 2005;115:412–22. doi: 10.1097/01.mlg.0000157852.01402.12. [PubMed] [CrossRef] [Google Scholar]
22. Kinoshita N, Tsuda M, Hamuy R, Nakashima M, Nakamura-Kurashige T, Matsuu-Matsuyama M, Hirano A, Akita S. The usefulness of basic fibroblast growth factor for radiation-exposed tissue. Wound Repair Regen. 2012;20:91–102. doi: 10.1111/j.1524-475X.2011.00758.x. [PubMed] [CrossRef] [Google Scholar]
23. Onah II. A classification system for postburn mentosternal contractures. Arch Surg. 2005; 140:671–5. [PubMed]
24. Tsai FC, Mardini S, Chen DJ, Yang JY, Hsieh MS. The classification and treatment algorithm for post-burn cervical contractures reconstructed with free flaps. Burns. 2006;32:626–33. [PubMed]
25. Dayan SH, Arkins JP, Antonucci C, Borst S. Influence of the chin implant on cervicomental angle. Plast Reconstr Surg. 2010; 126:141e–143e. [PubMed]
26. Zhang YX, Wang D, Follmar KE, Yang J, Ong YS, Messmer C, Coan B, Erdmann D, Qian Y, Levin LS. A treatment strategy for postburn neck reconstruction: emphasizing the functional and aesthetic importance of the cervicomental angle. Ann Plast Surg. 2010;65:528–34. [PubMed]
27. Huang CY, Yang JY, Hsiao YC. Chin projection creation in patients with facial and cervical burn scar contracture. Burns. 2010;39: 507–14. [PubMed]
28. Heidekrueger PI, Broer PN, Tanna N, Ninkovic M. Postburn head and neck reconstruction: an algorithmic approach. J Craniofac Surg. 2016;27:150–5. [PubMed]
29. Chen B, Song H, Xu M, Gao Q. Reconstruction of cica-contracture on the face and neck with skin flap and expanded skin flap pedicled by anterior branch of transverse cervical artery. J Craniomaxillofac Surg. 2016;44:1280–6. [PubMed]
30. Yang Z, Hu C, Li Y, Tang Y, Zhao M, Chen W, et al. Pre-expanded cervico-acromial fasciocutaneous flap based on the supraclavicular artery for resurfacing post-burn neck scar contractures. Ann Plast Surg. 2014;73 Suppl 1:S92–8. [PubMed]
31. Ma X, Li Y, Wang L, Li W, Dong L, Xia W, et al. Reconstruction of cervical scar contracture using axial thoracic flap based on the thoracic branch of the supraclavicular artery. Ann Plast Surg. 2014;73 Suppl 1:S53–6. [PubMed]
32. Murakami R, Fujii T, Itoh T, Tsutsui K, Tanaka K, Lio Y, Yano H. Versatility of the thin groin flap. Microsurgery. 1996;17:41–7. [PubMed]
33. Murakami R, Tanaka K, Kobayashi K, Fujii T, Sakito T, Furukawa M, et al. Free groin flap for reconstruction of the tongue and oral floor. J Reconstr Microsurg. 1998;14:49–55. [PubMed]
34. Goh TL, Park SW, Cho JY, Choi JW, Hong JP. The search for the ideal thin skin flap: superficial circumflex iliac artery perforator flap-a review of 210 cases. Plast Reconstr Surg. 2015;135:592–601. [PubMed]
35. Mahboub T, Khalil H. Post-transfer flap expansion for management of severe post-burn contraction neck. J Craniomaxillofac Surg. 2010;38:365–7. [PubMed]
36. Akita S. Treatment of radiation injury. Adv Wound Care. 2014;3:1–11. [PMC free article] [PubMed]
37. Wells M, Macmillan M, Raab G, MacBride S, Bell N, MacKinnon K, et al. Does aqueous or sucralfate cream affect the severity of erythematous radiation skin reactions? A randomised controlled trial. Radiother Oncol. 2004;73:153–62. [PubMed]
38. Kim JH, Jenrow KA, Brown SL. Mechanisms of radiation-induced normal tissue toxicity and implications for future clinical trials. Radiat Oncol J. 2014;32:103–15. [PMC free article] [PubMed]
39. Utsunomiya T, Shimada M, Imura S, Morine Y, Ikemoto T, Mori H, et al. Human adipose-derived stem cells: potential clinical applications in surgery. Surg Today. 2011;41:18–23. [PubMed]
40. Akita S, Yoshimoto H, Akino K, Ohtsuru A, Hayashida K, Hirano A, et al. Early experiences with stem cells in treating chronic wounds. Clin Plast Surg. 2012;39:281–92. [PubMed]
41. Akita S, Yoshimoto H, Ohtsuru A, Hirano A, Yamashita S. Autologous adipose-derived regenerative cells are effective for chronic intractable radiation injuries. Radiat Prot Dosimetry. 2012;151:656–60. [PubMed]
42. Prasanna PG, Stone HB, Wong RS, Capala J, Bernhard EJ, Vikram B, et al. Normal tissue protection for improving radiotherapy: Where are the Gaps? Transl Cancer Res. 2012;1:35–48. [PMC free article] [PubMed]
43. Noël D, Caton D, Roche S, Bony C, Lehmann S, Casteilla L, et al. Cell specific differences between human adipose-derived and mesenchymal-stromal cells despite similar differentiation potentials. Exp Cell Res. 2008;314:1575–84. [PubMed]
44. Sharp PA, Dougherty ME, Kagan RJ. The effect of positioning devices and pressure therapy on outcome after full-thickness burns of the neck. J Burn Care Res. 2007;28:451–9. [PubMed]
45. Clayton NA, Ward EC, Maitz PK. Intensive swallowing and orofacial contracture rehabilitation after severe burn: a pilot study and literature review. Burns. 2017;43:e7–17. doi: 10.1016/j.burns.2016.07.006. [PubMed] [CrossRef] [Google Scholar]
46. Stoddard FJ, Ronfeldt H, Kagan J, Drake JE, Snidman N, Murphy JM, et al. Young burned children: the course of acute stress and physiological and behavioral responses. Am J Psychiatry. 2006;63:1084–90. doi: 10.1176/ajp.2006.163.6.1084. [PubMed] [CrossRef] [Google Scholar]
47. Koller R, Kargül G, Giovanoli P, Meissl G, Frey M. Quantification of functional results after facial burns by the faciometer. Burns. 2000;26(8):716–723. doi: 10.1016/S0305-4179(00)00053-X. [PubMed] [CrossRef] [Google Scholar]
48. Goverman J, Mathews K, Goldstein R, Holavanahalli R, Kowalske K, Esselman P, et al. Adult contractures in burn injury: a burn model system national database study. J Burn Care Res. 2017;38:e328–36. doi: 10.1097/BCR.0000000000000380. [PubMed] [CrossRef] [Google Scholar] |


