马上注册,结交更多好友,享用更多功能,让你轻松玩转社区。
您需要 登录 才可以下载或查看,没有账号?注册
×
概要
介绍
腹腔镜肝切除术(LHR)的难度在涉及肝上节段的肿瘤中高于其他部位。然而,由于手术器械和程序得到改进和标准化,LHR可以在所有地区安全地进行。
目标
作者在作者医院的一系列接受LHR的患者中报告了作者的标准化外科技术和结果,并分析了手术结果,特别是关于切除部位的结果。
材料与方法
作者回顾性分析了2010年至2017年间接受标准化腹腔镜肝部分切除术的238名患者的数据。在标准化的LHR中,操作员在腹腔镜中心形成一个三角形腹腔镜,通过改变插入腹腔镜的端口保持同轴位置。
结果
左肝肿瘤切除右肝叶肿瘤的手术时间为202±92 min和140±104 min(p = 0.0024);术中出血量分别为80±170 ml和19±127 ml(p = 0.0016)。右肝叶的各个节段之间的手术结果没有差异。在左肝叶中,在III段腹腔镜肿瘤切除术中手术时间明显缩短(p = 0.0023)。
结论
在标准化LHR期间,与右肝叶相比,在切除左肝叶期间可以更容易地建立更好的视野。尽管如此,右叶的LHR可以使用各种手术器械和技术安全地进行。
关键词:切除部位,标准化腹腔镜肝切除术,同轴位置,三角形成,肋间隙,肝脏流入阻塞
介绍
腹腔镜手术的微创性质以及过去20年的显著技术改进使得腹腔镜手术成为许多领域(包括胃肠外科手术)常规开放手术的可行替代方案[1]。目前,通过腹腔镜手术进行各种肝脏手术,包括肝细胞癌或转移性肝癌的部分肝切除术[2]。既往研究表明腹腔镜肝部分切除术与开腹部分肝切除术相比,结果显著改善,包括围手术期出血减少,手术部位感染(SSI)发生率降低,术后炎症反应减少[ 3,4]。这些改善的结果是用于腹腔镜肝切除的外科手术和仪器的进步和改进的结果。
腹腔镜肝切除术最初用于肝下区域边缘部位的肿瘤切除术,但现在可用于切除较深的病变。在2014年在盛冈举行的第二届腹腔镜肝切除国际共识会议上,提出了一种难度评分系统,根据每位患者的术前信息确定腹腔镜肝切除术的难度。班等人。验证了用于腹腔镜肝切除术的难度分数,并报告了右肝叶肿瘤的难度较高,尤其是那些涉及肝上节段(第VII和VIII段)的肿瘤与其他腹腔镜肝肿瘤切除部位相比较[ 5]。尽管如此,在该研究中,他们发现腹腔镜肝切除治疗肝上段肿瘤已成功地在许多机构中进行。外科手术器械和技术的改进是导致以高难度为特征的肝脏区域中安全切除肿瘤的能力的原因。
目标
在这里,作者描述了这些标准化手术技术和结果在我院接受腹腔镜肝部分切除术的一系列患者中的应用。作者还分析了这些患者的手术结果,特别是关于切除部位的手术结果。
材料与方法
患者人群和选择
腹腔镜肝切除术(LHR)于1998年引入我院,到2010年作者开发了腹腔镜肝切除术的标准程序。这项研究包括自2010年以来接受腹腔镜肝切除术的患者,当时建立了外科手术的标准化。
在2010年2月17日至2017年2月27日期间,作者在日本高市市大阪医学院医院的238名连续患者中进行了肝脏肿瘤的腹腔镜肝部分切除术。根据大阪医学院附属医院伦理委员会(第1828号和1997年),所有患者都充分了解了研究设计,并提供了书面知情同意书。肿瘤大小<5 cm是LHR的主要标准;肿瘤数量和肿瘤位置不是标准。然而,门静脉或肝静脉受累或邻近器官侵犯的患者不被视为LHR的候选者。
将腹腔镜切开至肝切除的标准如下:(1)如果保留侧和切除侧的肝脏残端不能充分扩张,(2)如果术中出血无法控制,(3)如果失血量超过500 ml,(4)如果Pringle操作的总时间(肝血流阻塞)超过120分钟,(5)如果在手术期间无法控制术中胆漏。
外科手术
在这一系列研究中,所有患者均接受了可能的治愈性肝切除术,并完全切除了具有负宏观边缘的肿瘤。研究期间的所有程序均由三名经验丰富的肝胆外科医生(YI,FH,KU)中的一名进行。
作者部门常规使用的详细腹腔镜手术技术已在之前的报道中进行了描述[3,6,7]。 简而言之,将接受右肝叶肿瘤切除的患者置于左侧卧位。 将接受左肝叶肿瘤切除术的患者置于仰卧位。 在12mmHg的压力极限和6l / min的流速下诱导连续的二氧化碳(CO2)气腹,以降低气体栓塞的风险。 固定了4个5至12毫米套管针和45度腹腔镜(1588 AIM; Stryker Japan K.K.,Tokyo,Japan)。 对于接受右肝叶切除的头部肿瘤(第VII和VIII段)的患者,插入肋间端口(第VII段为两个端口;第VIII段为一个端口)(照片1)。
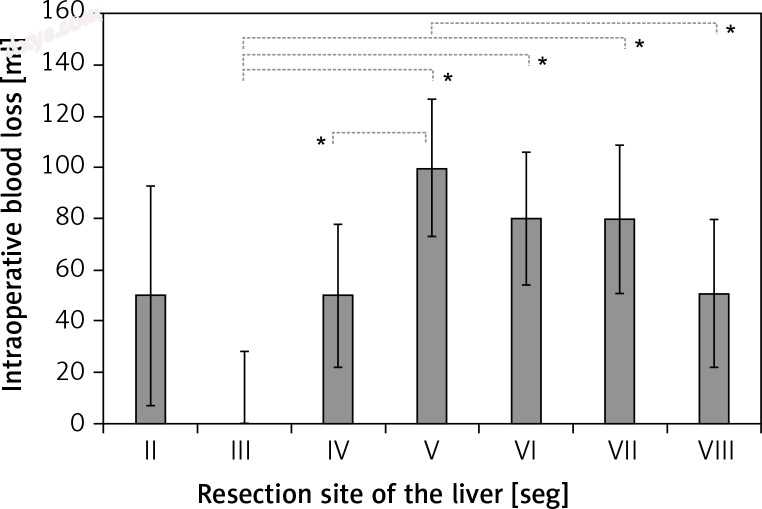
图2
比较每个肝切除部位和术中失血量。右肝叶和左肝叶的术中出血量分别为80±170 ml和19±127 ml;这种差异具有统计学意义(p = 0.0016)。特别是腹腔镜肝切除III段术中失血量明显减少
* P值<0.05。
开始操作肝脏;使用谐波手术刀(2009年至2013年)(Ultracision; Ethicon Endosurgery,Tokyo,Japan)或外科组织管理系统(自2014年起)(Thunderbeat; Olympus Inc.,Tokyo,Japan)分割肝外侧附件和三角韧带。 )解剖圆形和镰状韧带后。这种解剖通常被带到隔膜上,从而可以更有效地操作肝脏。
接下来,进行体外Pringle操作。通过从体外夹住血管闭塞管(Vessel-Clude; Argon Medical Devices Inc.,United States)来阻塞血流。采用间歇夹紧,夹紧15分钟,释放5分钟。
通过改变腹腔镜插入位置的端口,操作员形成一个三角形,腹腔镜位于中心,将操作者,目标区域和腹腔镜监视器放在一条直线上,保持同轴位置。在实质切除期间,中心静脉压(CVP)维持在3-5mmHg。在体外Pringle操作期间使用Sonop 5000超声解剖器(Hitachi Aloka Medical,Ltd。)和Thunderbeat实现了实质切除。使用软凝固系统结扎或凝固小血管。用夹子实现对主要血管的实质内控制,而用夹子或吻合装置获得胆管和血管胚根。将切除的未分开的标本置于塑料取出袋中,并通过略微扩大的脐周切口取出。
术前因素
检查的数据包括术前因素,手术因素和病理因素。调查的术前因素包括年龄,性别,病毒感染状况,血清天冬氨酸氨基转移酶(AST)水平,血清丙氨酸氨基转移酶(ALT)水平,血小板计数,血清白蛋白水平,总胆红素水平,凝血酶原时间(PT),Child-Pugh分类,和吲哚菁绿在15分钟时的保留率(ICG-R15)。
手术和病理因素
手术因素包括转换率,手术时间,术中失血量和输血要求。评估的病理因素包括最大肿瘤的大小,肿瘤的数量和手术边缘状态。 “R”分类表示手术后残留肿瘤的存在或不存在[8]。 R0切除是指在不侵犯肿瘤平面的情况下切除肿瘤,或在连续重新切除所涉及的边缘后实现负边缘。 R1切除涉及任何地方的显微镜阳性边缘,R2切除涉及具有可见肿瘤的宏观阳性边缘。
术后评估
评估以下参数:输血率,病理边缘,术后并发症,30天死亡率和住院时间。根据Clavien分类[9,10]对发病率进行分级。 SSI是根据疾病控制和预防中心(CDC)国家医院感染监测(NNIS)系统[11]定义的。
统计分析
连续变量表示为中位数±标准差(SD)。单变量分析结果通过Student's t和χ2检验,Mann-Whitney U检验,Wilcoxon符号秩检验或Fisher精确检验进行比较。通过Cox比例风险回归进行多变量分析。 p <0.05的值被认为是显著的。使用JMP版本12(SAS Institute,Inc.,Cary,NC,USA)进行所有统计学分析。
结果
患者人口统计学
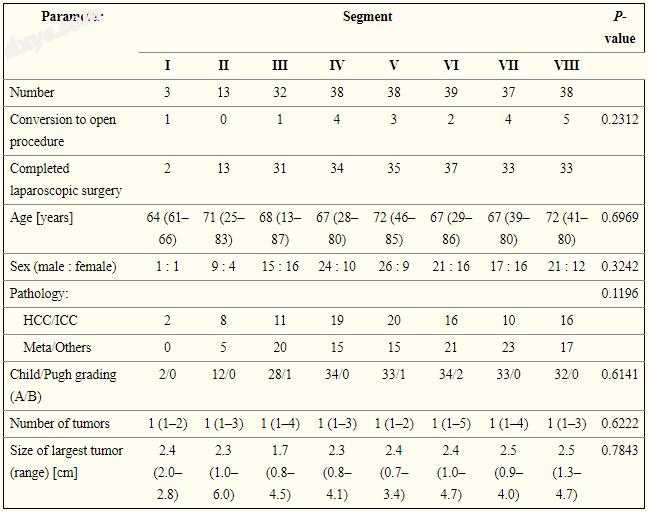
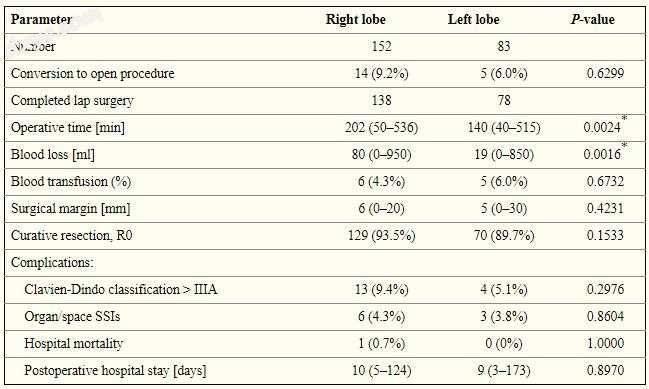
表I按组显示患者特征和手术结果。 对于涉及右肝叶和左肝叶的肿瘤,手术时间分别为202±92分钟和140±104分钟。 这种差异具有统计学意义(p = 0.0024)。 术中出血量明显不同,右侧和左侧肺叶分别为80±170 ml和19±127 ml(p = 0.0016)。 右肝和左肝叶肿瘤切除组之间的术后静脉内营养天数(p = 0.9181),术后住院天数(p = 0.8970)或并发症发生率(p = 0.2976)无显著差异(表II)。
表一
腹腔镜肝切除术患者的人口统计学数据
表二
腹腔镜肝切除术患者的手术结果
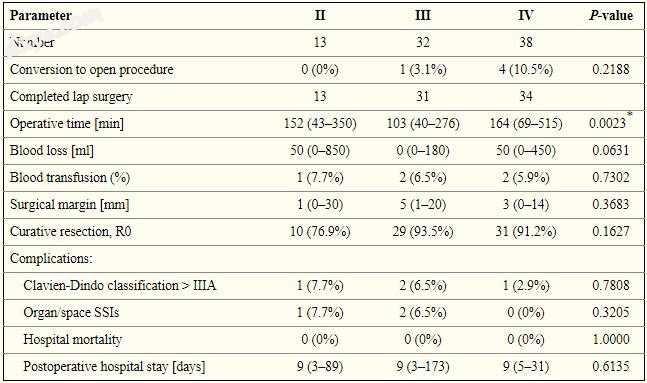
对于左肝叶肿瘤(II,III和IV段),术后病程无显著差异(表III); 然而,在III期腹腔镜肝切除术中手术时间明显缩短(p = 0.0023,图1,图2).2)。 对于右肝叶肿瘤(V,VI,VII和VIII段),各段之间的手术结果无显著差异(表IV)。
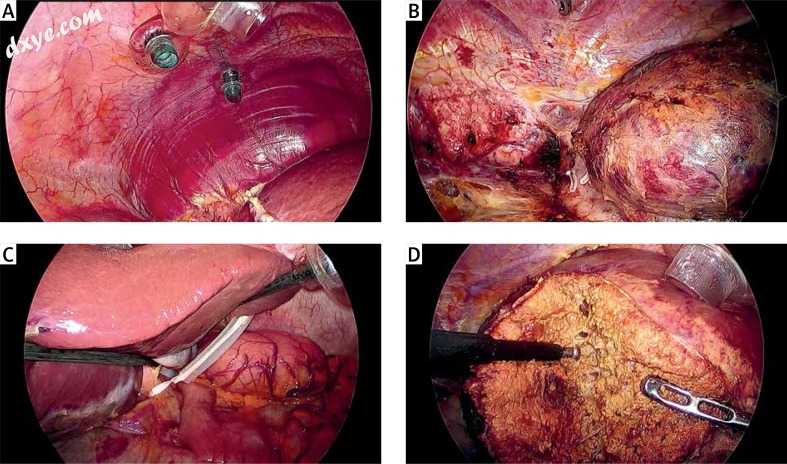
照片1
腹腔镜下肋间切除肝切除术。 A - 作者在第七和第十个肋间隙之间放置了两个带有气囊的5毫米肋间端口。 B - 侧视图:通过将腹腔镜插入肋间端口,作者能够从外部观察肝脏,从右肝静脉根部区域到全视野下腔静脉的整个长度。 C - 进行体外Pringle动作。通过从体外夹住血管闭塞管(Vessel-Clude; Argon Medical Devices Inc.,United States)来阻塞血流。采用间歇夹紧,夹紧15分钟,释放5分钟。 D - 操作者采取同轴位置,并在腹腔镜中心保持三角。通过这样做,操作者能够防止空间识别能力的丧失,并且控制右钳和左钳朝向目标器官
表III
腹腔镜肝切除术患者的手术结果
表四
腹腔镜肝切除术患者的手术结果
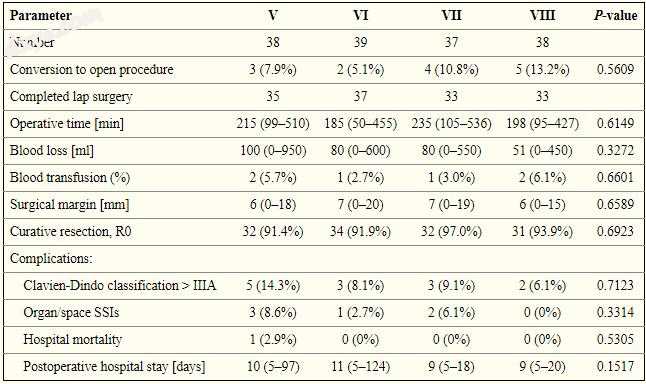
Lap – 腹腔镜,SSI - 手术部位感染。
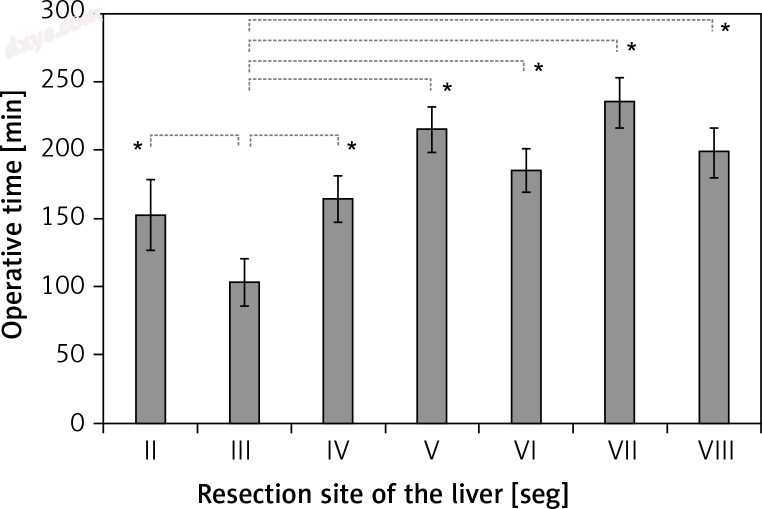
图1
每个肝切除部位和手术时间的比较。腹腔镜左肝叶肿瘤切除手术时间明显短于右肝叶手术时间(p = 0.0024)。特别是,腹腔镜肝切除III段的手术时间明显缩短
* P值<0.05。
从腹腔镜转为开腹肝切除的危险因素
比较有和没有转换为开放肝切除的患者的围手术期因素。检查了18个因素,包括患者因素,肿瘤因素和手术因素。
在所分析的因素中,丙型肝炎病毒感染(p = 0.0381),病理学(p = 0.0349),手术时间(p = 0.0148)和失血(p <0.0001)被发现是转为开放性肝脏的重要危险因素。切除。
转为开腹肝切除的患者的手术持续时间明显长于无转换的患者(分别为223±22 vs. 180±7 min; p = 0.0148)。受试者 - 操作者特征(ROC)曲线分析表明,手术时间的最佳截断值为195.0 min,对转换为开放性肝切除术的敏感性为85.0%,特异性为57.6%。
转化为开放性肝切除的患者的估计失血量明显高于未转换的患者(分别为515±55对50±17 ml; p <0.0001)。 ROC曲线分析表明,手术失血的最佳临界值为210.0 ml,对开放肝切除术的敏感性为80.0%,特异性为84.0%。
多变量分析表明,估计的失血量(p <0.0001;优势比(OR):12.295; 95%置信区间(CI):3.591-51.773)是转变为开放性肝切除的独立危险因素(表V)。
表五
转化为开放性肝切除的预测因素:单变量(A)和多变量(B)分析
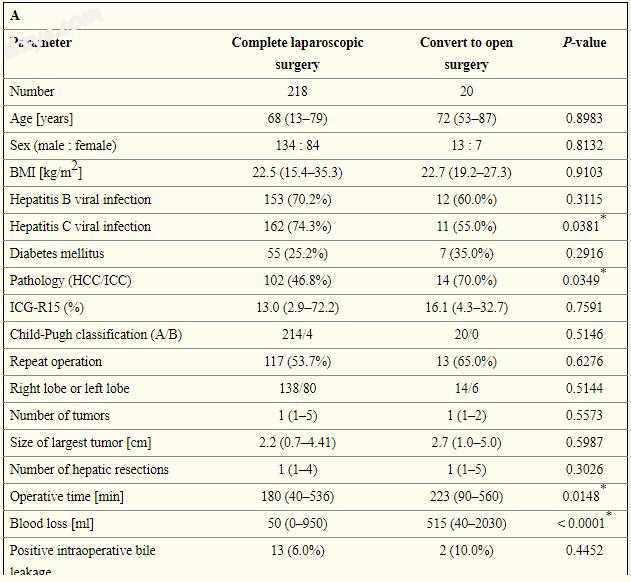
* P <0.05。BMI - 体重指数,ICG-R15 - 15分钟吲哚青绿保留率,HCC - 肝细胞癌,ICC - 肝内胆管细胞癌。
讨论
腹腔镜肝切除术的使用已被迅速采用,因为其优点包括放大和观察的益处,气腹压力对止血的影响以及低侵入性。从侵袭性和美容性的观点来看,腹腔镜肝部分切除术优于剖腹探查部分肝切除术。然而,就视野和可操作性而言,仍存在关于腹腔镜肝切除的安全性的担忧。当首次进行时,认为腹腔镜肝切除的难度在涉及肝上节段(节段VII和VIII)的肿瘤中比在其他部位观察到的更大。在这些部分中,钳的使用是有限的,并且难以建立足够的视野[5]。然而,手术工具已经迅速发展,并且随着这些改进和外科手术的标准化,腹腔镜肝切除的结果和安全性将继续改善。本研究报告的结果取决于标准腹腔镜肝脏部分切除术中的肝切除部位。
在这项研究中,腹腔镜切除左肝叶的手术结果优于切除右肝叶肿瘤。这些结果被认为受到左肝叶操作更容易,视野容易建立以及可用工作空间广阔的影响。在左肝叶的所有部分中,通过分离肝脏韧带,镰状韧带,左冠状韧带和三角韧带可以建立良好的视野。这允许左叶的操作,而不限制在肝切除期间使用钳。对于肝左叶的区段3尤其如此,其中可以在开始腹腔观察时建立优越的视野而不进一步操作肝脏。
然而,在腹腔镜右肝叶肿瘤切除术中通常需要先进的外科手术。在右肝叶腹腔镜切除术期间建立视野和使用钳的限制的困难导致肝上节段(段VII和VIII)中肿瘤切除的高度困难。在腹腔镜肝切除术期间,操作者与肝切除部位和腹腔镜监视器对齐,处于同轴位置并且以腹腔镜为中心固定三角形。在该位置,操作者可以防止由于腹腔镜肝切除期间的特殊姿势导致的空间感知能力的损害,并且可以容易地控制双侧镊子朝向目标器官。基于这种方法,当在肝上节段(段VII和VIII)中进行腹腔镜肝切除肿瘤时,插入一个或两个肋间端口。通过将腹腔镜插入肋间端口或位于右侧外侧区域的端口,可以直接看到从右肝静脉根部到下腔静脉的整个区域。通过侧向入路,涉及肝上节段的肿瘤被分离,同时保持同轴位置和三角形形成。由此,可以充分确保切除侧和隔离侧的分离。不执行盲操作,并且钳子在切向投影中几乎不面向隔离侧,这提高了可操作性。
如上所述,通过建立良好的视野和保持钳子的可操作性来控制出血是安全地进行腹腔镜肝切除的关键。如表V所示,多变量分析表明,估计的术中失血量与腹腔镜切开至开腹肝切除术有关。为了降低开放切除的转换率,可以通过提高气腹压力,降低中心静脉压,降低通气量和降低呼气末正压来降低静脉出血[12]。此外,为了分离肝实质,作者中断了所有患者的肝脏血液流入,除非由于粘连而难以接管肝门。通过使用这些技术,可以减少术中失血,可以安全地进行手术,并且肝脏的孤立侧可以保持干燥[13]。
结论
与右肝叶肿瘤切除术相比,在腹腔镜左肝叶肿瘤切除术中,操作更容易并且可以建立更好的视野。此外,对于右肝叶肿瘤的腹腔镜肝切除术可以更安全地进行,包括肝脏血流入,同轴定位,维持腹腔镜为中心的三角形,以及常规放置肋间口。肝上段切除肝脏(VII和VIII段)。然而,作者的研究受到研究中包括的少数患者的限制,并且手术形式仅限于部分肝切除,这可能引起一些偏倚。需要额外的随机临床试验和荟萃分析。
参考:
Comparison of resection site of standardized laparoscopic hepatic tumor resection
1. Inoue Y, Hayashi M, Tanaka R, et al. Short-term results of laparoscopic versus open liver resection for liver metastasis from colorectal cancer: a comparative study. Am Surg. 2013;79:495–501. [PubMed] [Google Scholar]
2. Nord HJ. Laparoscopy – a historical perspective: are gastroenterologists going to reclaim it? Gastrointest Endosc. 2008;68:67–8. [PubMed] [Google Scholar]
3. Ishizawa T, Gumbs AA, Kokudo N, et al. Laparoscopic segmentectomy of the liver: from segment I to VIII. Ann Surg. 2012;256:959–64. [PubMed] [Google Scholar]
4. Inoue Y, Asakuma M, Hirokawa F, et al. Single port access for laparoscopic lateral segmentectomy. Videosurgery Miniinv. 2017;12:357–65. [PMC free article] [PubMed] [Google Scholar]
5. Ban D, Tanabe M, Ito H, et al. A novel difficulty scoring system for laparoscopic liver resection. J Hepatobiliary Pancreat Sci. 2014;21:745–53. [PubMed] [Google Scholar]
6. Inoue Y, Hayashi M, Komeda K, et al. Resection margin with anatomic or nonanatomic hepatectomy for liver metastasis from colorectal cancer. J Gastrointest Surg. 2012;16:1171–80. [PubMed] [Google Scholar]
7. Inoue Y, Tanaka R, Komeda K, et al. Fluorescence detection of malignant liver tumors using 5-aminolevulinic acid-mediated photodynamic diagnosis: principles, technique, and clinical experience. World J Surg. 2014;38:1786–94. [PubMed] [Google Scholar]
8. International Union Against Cancer (UICC) In: TNM Classification of Malignant Tumours. 7th ed. Sobin LH, Gospodarowicz MK, Wittekind C, editors. New York: Wiley-Blackwell; 2009. [Google Scholar]
9. Dindo D, Demartines N, Clavien PA. Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of a survey. Ann Surg. 2004;240:205–13. [PMC free article] [PubMed] [Google Scholar]
10. Clavien PA, Barkun J, de Oliveira ML, et al. The Clavien-Dindo classification of surgical complications: five-year experience. Ann Surg. 2009;250:187–96. [PubMed] [Google Scholar]
11. Mangram AJ, Horan TC, Pearson ML, et al. Guideline for prevention of surgical site infection, 1999. Centers for Disease Control and Prevention (CDC) Hospital Infection Control Practices Advisory Committee. Am J Infect Control. 1999;27:97–132. [PubMed] [Google Scholar]
12. Uchiyama K, Ueno M, Ozawa S, et al. Half clamping of the infrahepatic inferior vena cava reduces bleeding during a hepatectomy by decreasing the central venous pressure. Langenbecks Arch Surg. 2009;394:243–7. [PubMed] [Google Scholar]
13. Pringle JH. Notes on the arrest of hepatic hemorrhage due to trauma. Ann Surg. 1908;48:541–9. [PMC free article] [PubMed] [Google Scholar] |


