马上注册,结交更多好友,享用更多功能,让你轻松玩转社区。
您需要 登录 才可以下载或查看,没有账号?注册
×
概要
胸疝的特征在于胸腔内容物突出于其正常解剖学界限或胸腔内腹部内容物的延伸。胸疝可以是先天性的,也可以是病因学的。它们可以发生在胸腔入口,胸壁或横膈膜的水平。对于其他适应症获得的成像,胸疝可以是对症或偶然发现的。胸疝的并发症包括嵌顿,创伤和狡窄坏死。多种成像方式可用于评估胸疝。射线照片通常提供诊断的第一条线索。上消化道造影可以识别肠疝和相关并发症。 CT和偶尔MR可用于进一步评估这些异常,准确识别疝的类型,其内容,相关并发症,并提供手术计划的路线图。在本文中,作者回顾了不同类型的胸疝和成像在评估这些疝气中的作用。
教学点
•超出胸廓解剖范围的肺内容物突出构成疝气。
•胸疝的并发症包括嵌顿,创伤和狡窄坏死。
•多种成像方式可用于评估胸疝。
•CT是识别胸疝及其并发症的首选成像方式。
•成像可以为手术计划提供路线图。
关键词:肺疝,膈疝,胸骨裂开,心包疝
介绍
胸疝的特征在于胸部内容物突出于其正常解剖学范围之外或者腹部内容物延伸到胸腔中。 胸疝可以是先天性的或在病因学中获得。 获得后,这些通常是创伤后或手术后(图1)。 它们可以发生在胸腔入口,胸壁或横膈膜的水平[1]。 膈疝可以是纵隔或胸膜内。 这些疝气可以在胸部或腹部的常规成像期间针对其他适应症进行症状性或偶然性检测。 胸疝的并发症包括嵌顿,创伤和狡窄坏死。 这些并发症可以模拟胸部和腹部疼痛的心血管或胃肠道原因,其中一些常常需要紧急干预或手术。
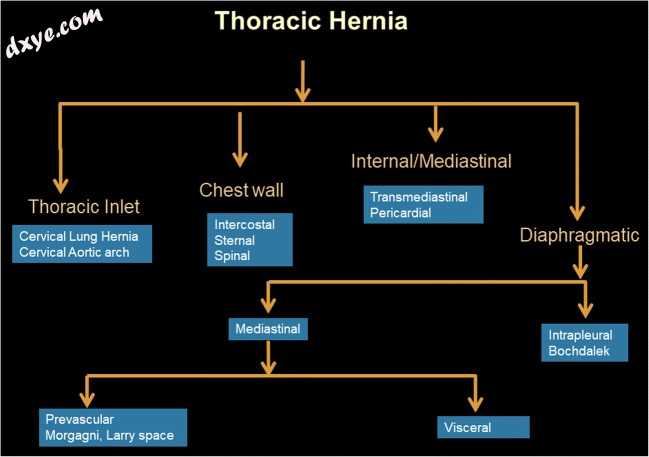
图1
描绘在成像中看到的不同类型的胸疝的流程图
成像胸疝
不同的成像方式可用于鉴别胸疝,具有各自的优缺点(表(表1),1),包括X线片,上消化道系列,超声,计算机断层扫描(CT)和磁共振成像(MRI)。 成像在疝气评估中的作用(表(表2)2)包括确定诊断,表征类型,界定范围,确定内容,检测并发症和提供干预/手术的路线图。
表格1
用于评估胸疝的不同成像方式
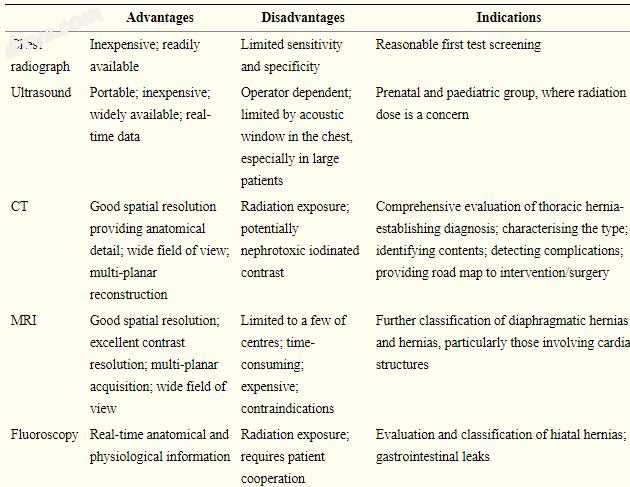
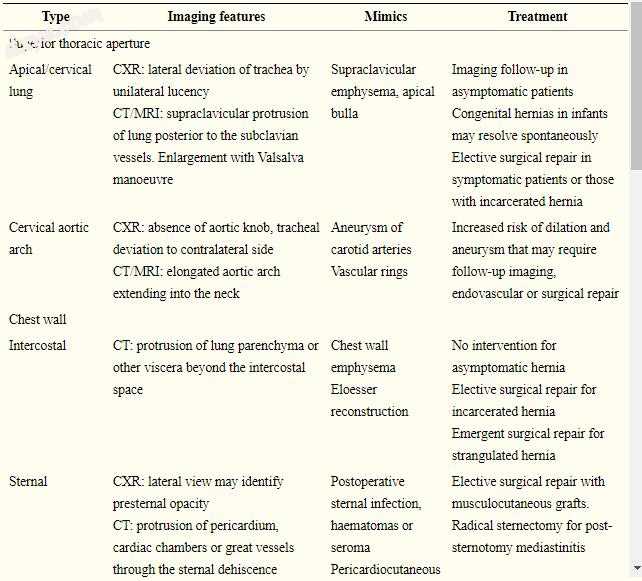
表2
总结不同类型的胸疝,其影像学表现,模拟和治疗的简要描述
CXR胸部X线片,GE结肠胃食管连接处
X光片
胸部X线片(CXR)通常是成人中首次使用疑似胸部病变的成像方式,可能是胸疝的第一道线索。
胃肠道造影
透视下的胃肠造影照相术是识别肠疝进入胸腔的有用方式。口腔对比(UGI)的上消化道成像可用于鉴别和分类食管裂孔疝。较低的胃肠造影(对比灌肠)可用于识别大肠进入胸腔的大脑和大肠导管的并发症。在疑似肠穿孔的患者中,水溶性造影剂最初用于UGI和灌肠检查。在作者的机构,低渗透非离子对比例如碘海醇350 mgI / ml(Omnipaque 350,GE Healthcare,Princeton,NJ,USA)成人和Optiray 240(Ioversol 240 mgI / ml,Guerbet LLC,Bloomington,IN,USA) )使用<17岁的儿童。当使用水溶性或低渗透剂的图像不是最理想时,作者限制使用口腔钡来评估大身体习惯或覆盖金属硬件的患者的任何泄漏。一些放射科医生不愿在年轻或虚弱的老年患者中使用硫酸钡,这些老年患者可能有误吸风险,或者可能需要额外的成像[1,2]。
超声
超声(US)是先天性畸形产前评估的首选方式,可以识别先天性膈疝。它可用于儿科年龄组,其中辐射剂量是一个问题。它便携,价格低廉,可广泛使用,并提供实时信息。美国可以是确认浅表性胸疝的有用方式。
CT检查
CT是成人胸疝的鉴别和表征中选择的横断面成像模式。 CT准确识别和分类胸疝以及疝囊的内容。在CT上,可以测量疝囊的尺寸和缺损的大小。 CT对于评估任何相关并发症也很有用。现代多检测器CT(≥16个检测器行)产生各向同性体素,可以在多个不同的平面中显示。这些轴向CT图像的图像分析可以生成三维,体积或表面渲染图像以及最小和最大强度预测,以便更全面地检查疝气。大多数胸疝可以通过胸腔单次静脉相对比增强CT进行鉴别和分类。在作者的实践中,作者对那些怀疑有肠疝的患者或同时进行腹部CT的患者使用口服对比剂。
磁共振成像
MRI可以识别非急性心包和膈疝。没有静脉造影的MRI可以表征无法接受CT对比的患者的疝气(肾功能衰竭,先前造影剂给药后的过敏反应史等)。可以获得多次采集,这可以帮助表征腹部内容物(例如肝脏或脾脏)的突出,因为这些可以在单相对比增强CT检查中次优地表征[3]。稳态自由进动序列用于识别子宫内胎儿先天性膈疝。 T2加权轴向,冠状和矢状图像有助于识别膈肌或胸壁中的缺陷。注射静脉内钆后的对比增强图像可以表征疝囊的内容并且还评估突出的固体内脏中的任何并发症。在吸气,呼气和Valsalva动作期间的时间分辨动态成像可用于显示具有不同腹部或胸内压力的疝气的变化。
胸疝
疝气位于胸廓上方
上胸孔由第一肋骨和第一胸椎的柄部形成。肺顶端覆盖顶端胸膜和Sibson筋膜,从C7延伸到第一肋骨。肺的顶点仅延伸至第一肋骨的胸骨末端的上边界约2.5-5cm。胸腔内容物在胸腔入口上方的任何延伸构成颈部或顶端疝。
颈性肺疝
颈区域的肺部突出是罕见的,并且大多在病例报告中描述。肺疝可以是颈部,胸部或膈肌。宫颈疝可见于哮喘患儿[5],阻塞性肺病患者和手术后[4](图2a,b)或创伤。创伤后疝可以在Sibson筋膜中形成泪液后遗症,具有明确的疝囊。疝气可能是由于胸膜上的松弛而存在长期升高的胸腔内压力而没有疝囊[5]。这些可以是单边的或双边的。
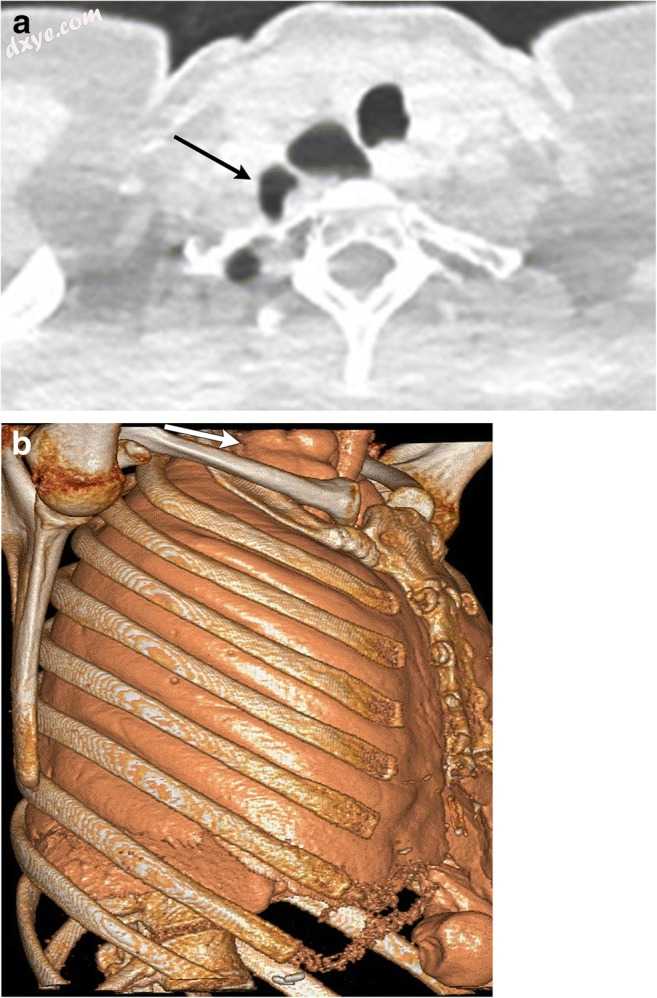
图2
a,b一名67岁的女性正在接受肺结节和近期急性呼吸道疾病急性发作的评估。轴向CT(a)显示右上叶的近前段(黑色箭头)延伸到颈部区域。体积渲染图像(b)清楚地描绘了锁骨和第一肋骨上方的突出肺(白色箭头)。突出的肺部会对气管造成平滑的印象。这些可能导致气管偏离或压缩
在X线片上,单侧颈部肺疝被视为胸腔入口水平的单侧透明度,伴有对侧气管偏离[8]。术后皮下气肿可以模拟颈部肺疝,但可以在CT上进行鉴别。无症状的锁骨上肺疝不需要手术修复[6],大多数小儿疝气自行消退。当出现并发症时,疝气的手术修复可能是必要的,例如神经压迫引起的神经性疼痛[5]。
颈主动脉弓
颈主动脉弓是一种罕见的先天性异常,其中主动脉弓延伸到颈部的软组织中(图3a,b)。主动脉弓通常从右侧第四鳃弓发展而来。然而,在颈主动脉弓中,它从第三个弓形成,第四个弓是闭锁的[7]。颈椎主动脉弓在左侧更常见[8]。颈主动脉弓可表现为脉动性锁骨上肿块。在CT和MRI上,足弓在胸骨上方延伸到颈部区域。这可以扩张并形成动脉瘤。扩张可能是由于异常发育,结缔组织异常或血流动力学改变伴高主动脉壁应力和创伤[9]。颈椎主动脉弓动脉瘤采用血管内修复术或胸骨切开术后插入移植术治疗。
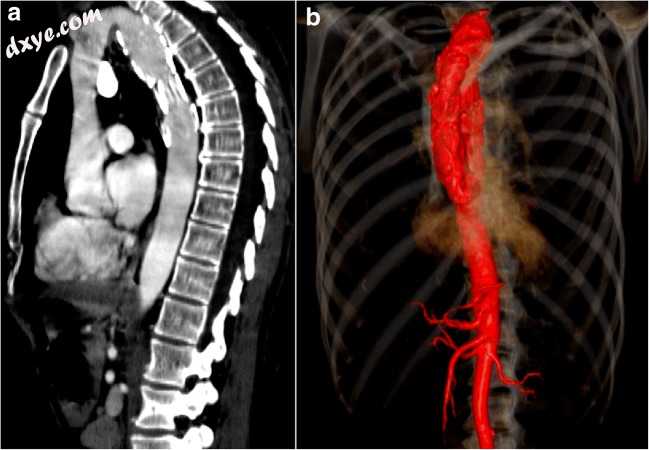
图3
a,b一名69岁的女性,患有治疗小细胞癌的远程病史和降主动脉的支架移植物放置,伴有缓慢进展的左锁骨上肿块。轴向对比增强CT(CECT)图像(a)高于胸锁关节水平和体积渲染图像(b),识别延伸到左颈区的高,扩张和细长的主动脉弓。这些主动脉弓可以扩张,形成动脉瘤,这可能对胸腔入口周围结构造成质量影响
胸壁疝气
胸壁由皮肤,浅筋膜,深筋膜,肌肉和胸骨(肋骨,胸骨,锁骨,肩胛骨和椎体)组成。肋间隙有三个肋间肌(外部,内部和内部),它们很薄或不足,在胸骨附近前面和靠近椎体的后部。有一个额外的胸膜空间,位于肋骨的内表面和顶叶胸膜之间[10]。胸壁疝气可以是肋间,胸骨或脊柱的位置。
肋间肺疝
肋间肺疝是通过胸壁缺陷导致的肺实质突出。关于这些疝气的文献中仅报道了少数病例[11]。肋间肺疝可以是先天性的(与肋软骨缺损或肋骨发育不全有关),自发性(胸腔内压力突然增加,如咳嗽,打喷嚏,吹奏乐器等),或者更常见的是继发于创伤或愈合不足经胸外科手术(胸廓切开术,胸腔镜,微创心脏手术)[11-13]。肺是肋间疝囊最常见的内容。对于先前开胸或胸管置入的患者,肋间疝可以是无症状的或存在局部胸痛。
平片上可能会错过肋间疝[11]。 在CT和MRI上,通过胸壁缺损识别肺部与胸膜的突出,仅有一层薄薄的筋膜和皮肤覆盖突出的肺部。 肺部突出可出现肺不张或瘢痕。 最大强度投影(MIP)图像可用于评估血管压缩,最小强度投影(MinIP)图像可用于评估气道压缩,体积渲染可用于术前计划(图4a,b)。 生物假体植入物优于刚性医疗植入物以封闭这种疝气[14]。 伴有疼痛或肺部陷阱的疝气需要用外科网状移植物重建以封闭缺损,因为被截留的肺可能经历勒死和反复感染[12]。
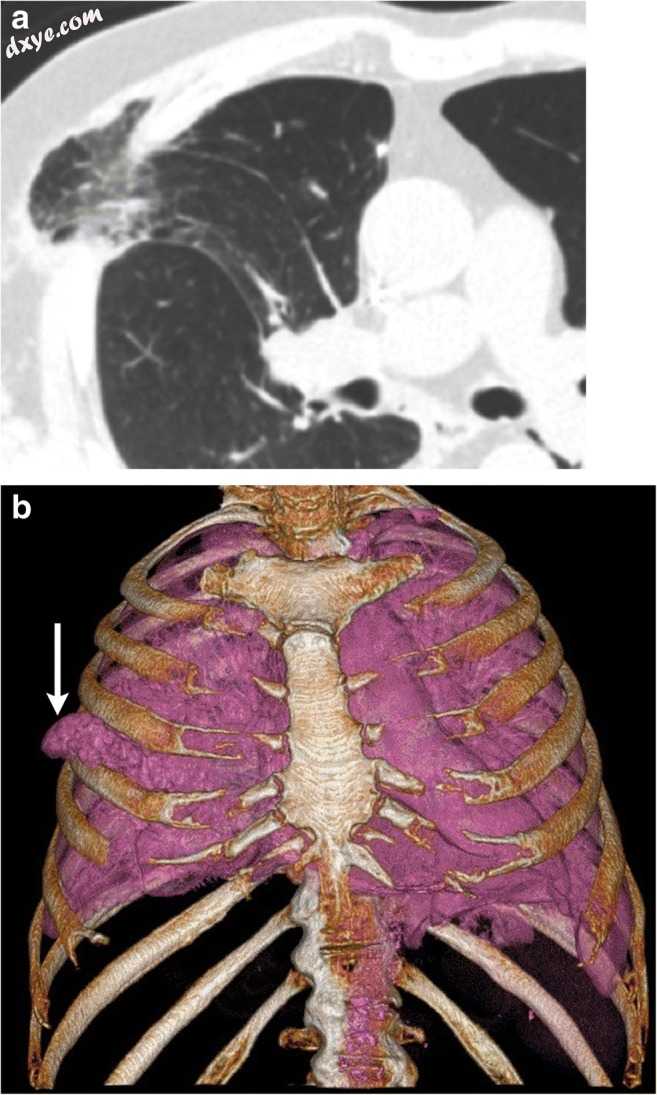
图4
a,b一位70岁的女性,有胸腔积液引流胸腔积液史。对于I期肺癌,具有先前右上叶楔形切除的患者的轴向CT(a)和体积渲染图像(b)识别右上叶的局灶性肋间疝(白色箭头)。疝气的颈部很窄,表明有嵌顿。另外,支气管血管蒂的取向异常,细支气管狭窄。肺部突出的磨玻璃样不足表明肺不张(电影1)。除非无症状,否则建议对这些疝气进行选择性修复
腹内脏疝腹部疝
腹部肋间疝是一种罕见的疝气,通过膈肌和邻近肋间肌的缺陷而发生[15]。它通常继发于穿透性或钝性胸腹部损伤,可见于COPD,骨质疏松症和肌肉无力的患者。即使在诸如咳嗽或举重之类的轻微事件之后,这些也可能发生。临床上,这些疝气可以很容易地识别,因为它们的表面软组织位置,但这些可以在CXR上错过。肝脏可以在右侧(图5)和左侧的脾脏或腹膜(图6a,b)疝出。
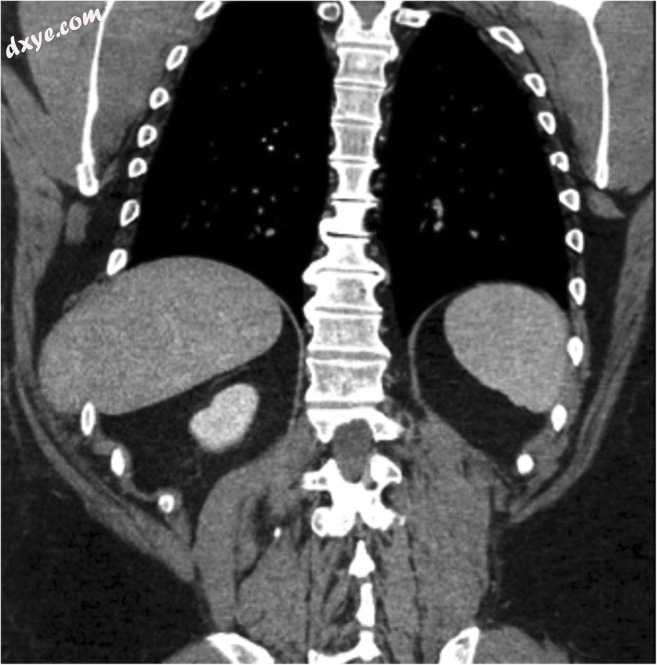
图5
具有远程创伤史的患者的冠状位CT显示肝脏的肋间疝
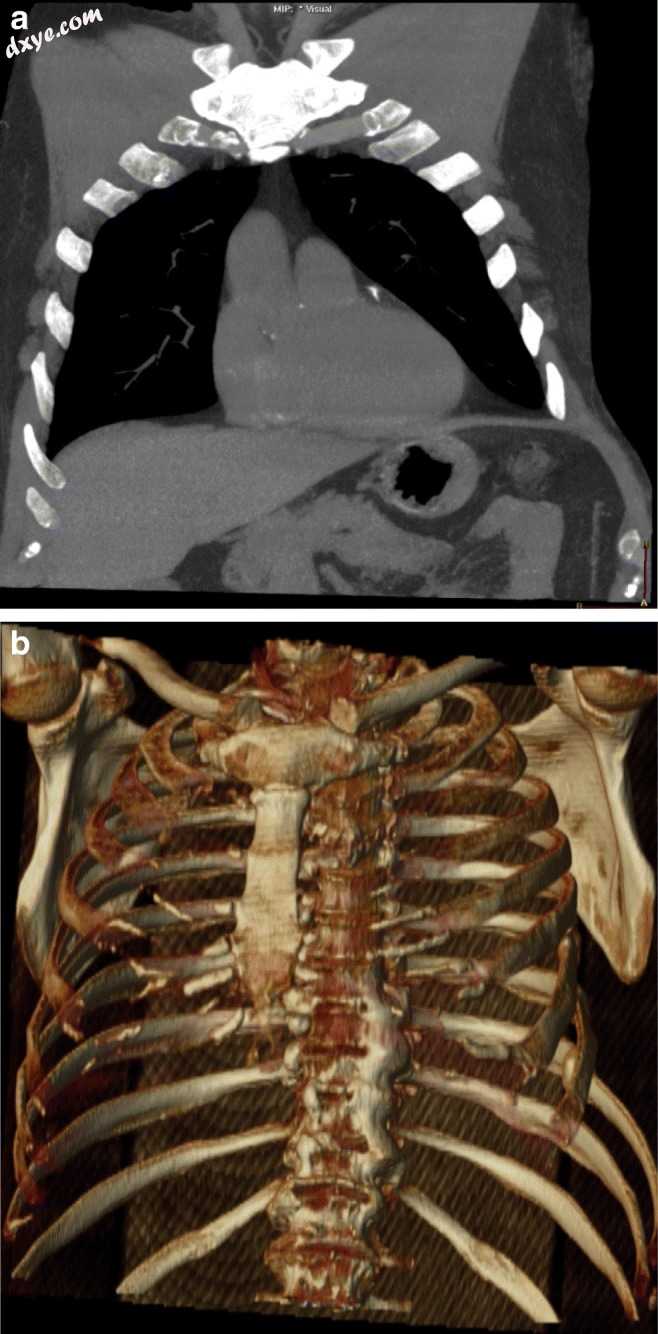
图6
a,b冠状面MIP通过左侧第7-8肋间隙(a)显示肠系膜脂肪的突出,并进行体积渲染重建(b)
胸骨裂开和疝气
胸骨裂开是心脏手术罕见但严重的并发症。它代表骨性胸骨的分离,并且可以在正中胸骨切开术后0.2-5%的患者中发生。这可能是由于原发性不愈合,伤口愈合不良或过早过度[16],可能与感染和纵隔炎有关。早期开裂很难在临床上确定。心血管结构通常通过开裂而突出。还报道了胃疝[22],特别是正中胸骨切开术延伸到上腹部并削弱上腹壁[23]。
在CXR上,胸骨线的改变配置可能暗示即将开裂[17]。线的整体位移表明胸骨边缘的总分离。 CXR上厚度超过3 mm的中段条纹也提示胸骨开裂[18]。主动脉,肺动脉,右心室或右心室流出道可通过胸骨开裂(图7)突出,并可在CT或MRI上识别。一层薄薄的心包,皮下脂肪和皮肤覆盖在心肌上,提供的覆盖范围不足,甚至可以轻微创伤。带有皮瓣覆盖的胸骨清创术是治疗的主要手段[19]。
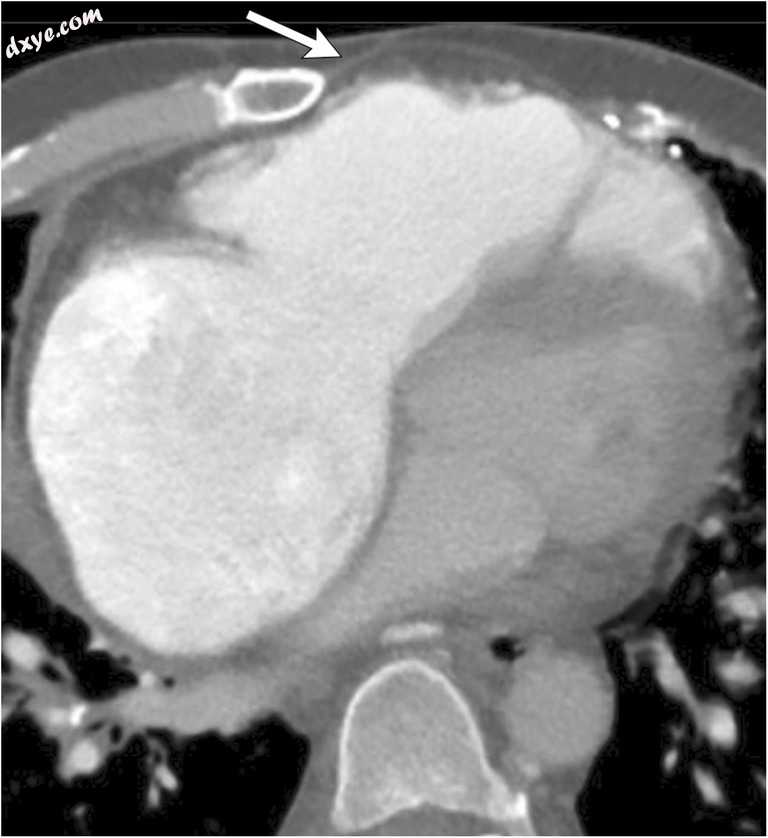
图7
一名55岁男性,在升主动脉移植物置换术后有升主动脉瘤状态史。轴向CECT通过胸骨缺损表现出右心室突出的胸骨裂开。只有一层薄薄的心包(白色箭头)将皮肤与心肌分开
较大的网膜移植物的免疫学和血管生成性质使其可用于治疗纵隔炎和伤口感染。大网膜的纵隔放置代表获得性疝,因为网膜从腹部收获并通过外科手术创建的经膈膜开口重新定位到胸腔中。网膜移植物有时也用于支撑肺切除术后的支气管残端并填充肺切除术后的空间。
心包疝
心包缺损可以是先天性的,也可以是在心包切除术,肺部或心脏移植或创伤后获得的。它可以是完整的也可以是部分的。据报道,先天性心包缺损的发生率<1 / 10,000,基于尸检[20]。先天性心包缺失是由于共同的主要静脉的早期退行异常导致的,这导致胸膜心膜的不完全形成。钝性创伤中的心包撕裂最常发生在左侧胸膜心包平行于膈神经的位置[21]。心包缺陷的真实发生率很可能被低估,因为许多病例可能仍无症状[22]。虽然先天性完全左侧缺损更常见,但部分缺陷往往是症状性的并且并发症的发生率更高。部分缺损可导致肺实质进入心包缺损。在成像时,可以在升主动脉和主肺动脉之间识别肺疝(图8a,b)[23]。心脏房的局灶性突出(图9a,b)也可以通过这种部分缺陷发生。疝气最常见的心腔是左心耳。心脏收缩期间的突出更为突出。
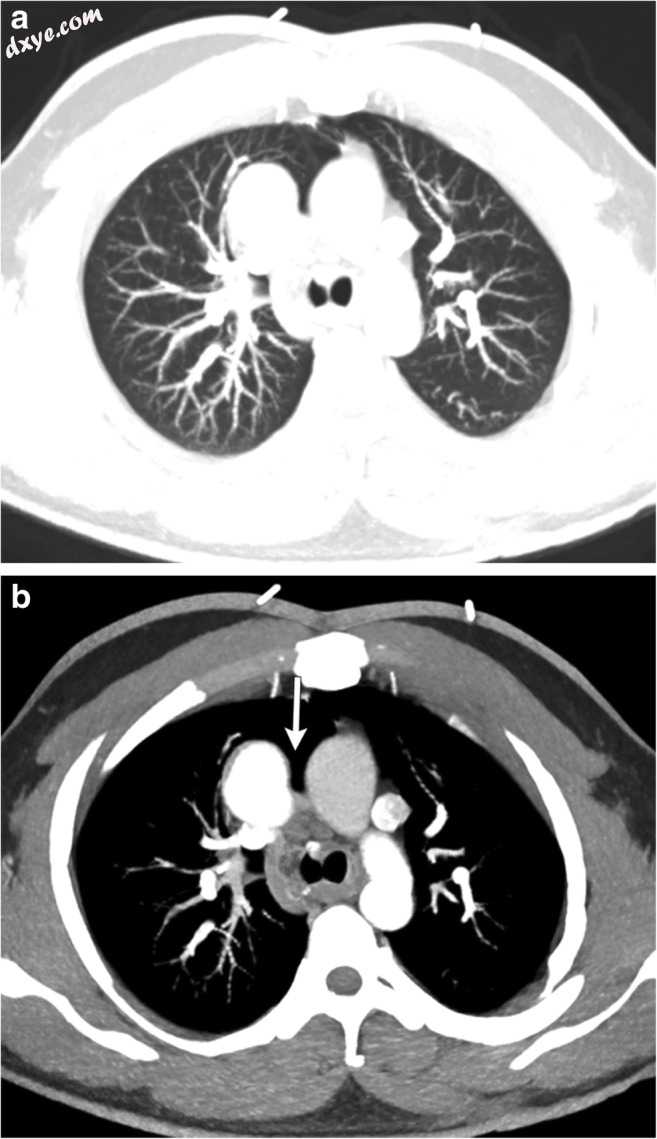
图8
a,b一名26岁男性,有Shone复杂病史,缩窄后修复,主动脉瓣下切除和瓣膜上环二尖瓣切除术。 肺(a)和纵隔(b)窗口中的最大强度投影轴向CECT图像显示升主动脉和主肺动脉之间的右上叶前段(白色箭头)的局灶性突出。 这种肺部突出是心包局灶性缺失的结果
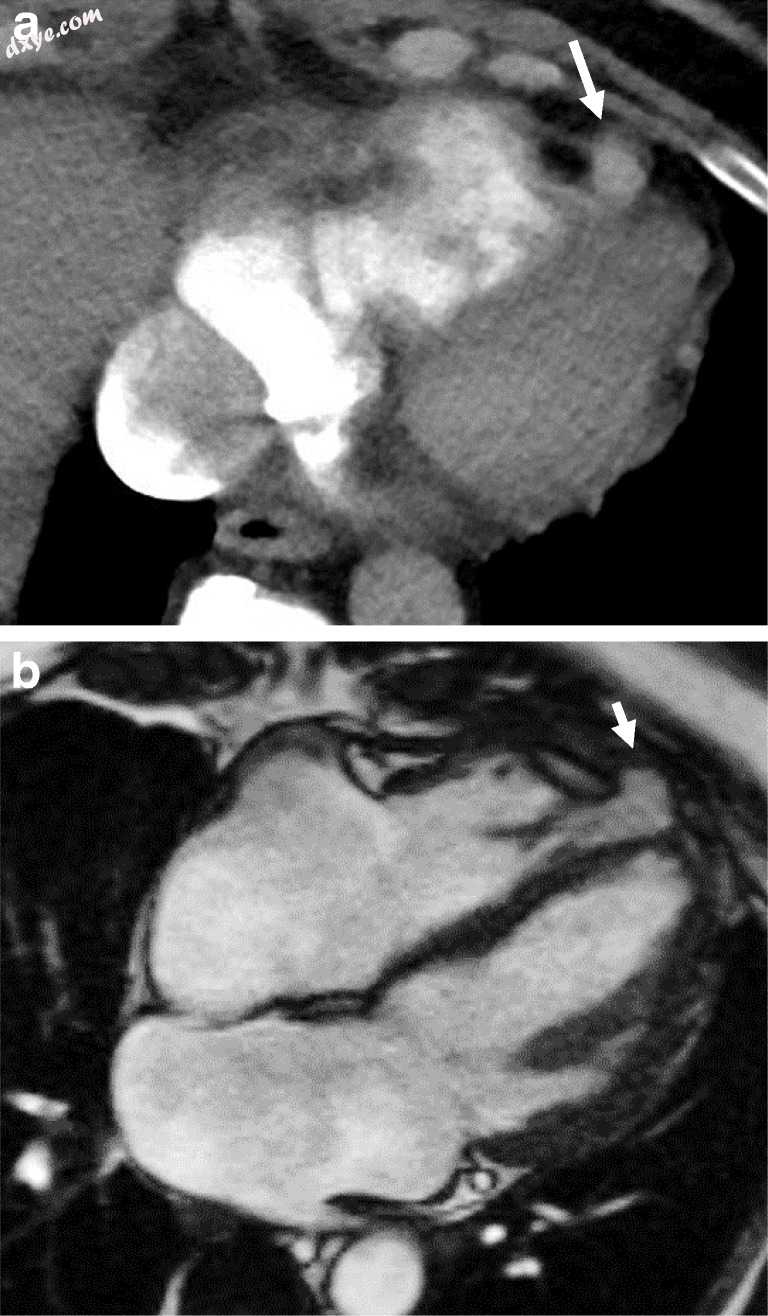
图9
a,b CT(a)和MRI(b)图像通过心脏显示右心室心肌的局灶性疝通过先天性前心包缺损(白色箭头)
脊柱疝:胸椎脑膜膨出
椎管内容物可以疝入胸壁,胸膜或后纵隔,形成胸内脑膜膨出[24]。 先天性脑膜膨出可见于神经纤维瘤病患者,而获得性脑膜膨出则发生在椎板切除术后或与肌肉骨骼畸形相关[25]。 这些通常是无症状的。 CXR可以识别后纵隔的软组织病变。 在CT和MRI上,可以确定通过椎间孔形成囊肿的脑膜和脑脊液的突出[28]。 MRI在识别神经基质中优于CT,神经基质存在于脊髓脊膜膨出,但不存在于脑膜膨出(图10)。
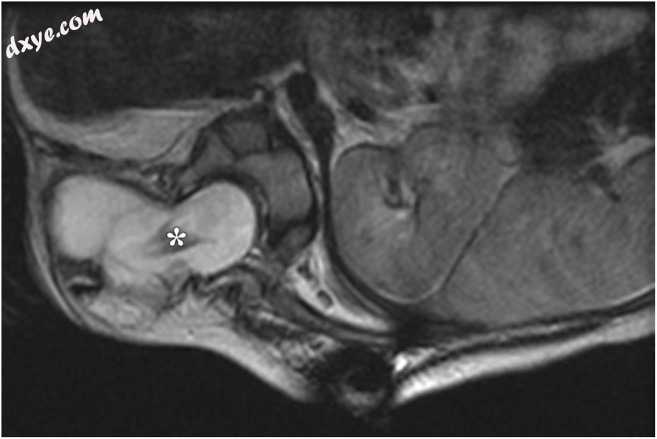
图10
轴位T2加权MRI在1个月大的婴儿右后路椎旁肿块。 非造影轴位T2加权MRI确定右侧外侧脊髓脊膜膨出。 除了突出的脑膜外,还可以在MRI上看到CT(未显示)上未见的神经基板(白色星形),从而证实这是一个侧胸椎脊髓膜膨出
经纵隔疝
经纵隔疝是指胸膜囊的突出及其在纵隔至对侧的内容物。 该实体不同于纵隔移位,其中整个纵隔向一个半胸移位。 在患有隔离,弯刀综合征或肺切除术后的患者中可见肺部突出,并且通常发生在前纵隔,而胸膜囊和液体的突出通常发生在后下纵隔[26]。 已经描述了巨大肺大泡的纵隔脑疝[27]。
在CXR上,前交界线被移位。在侧位X线片上,疝气被视为可以模拟前部气胸的胸骨后透明度。 CT是选择的形式,并且识别前或后连接线的位移而不移位纵隔。在全肺切除术后,随着时间的推移,手术后空间逐渐充满液体并随着时间的推移而更换空气(图11)。肺切除术后空间的消除和中线正常肺的突出通常需要数周到数月[28]。右肺切除术后儿童和青年人描述了肺切除术后综合征。它是由于左肺过度充气,中线向右侧突出[29]。这种突出导致左主干支气管的拉伸和压缩,肺动脉和降主动脉之间的气管和左支气管变窄(图12a)。组织扩张器或硅胶乳房植入物用于肺切除术后空间以防止这种纵隔脑疝。在成长中的儿童中,可能需要额外或更大的植入物来治疗该实体(图12b)。
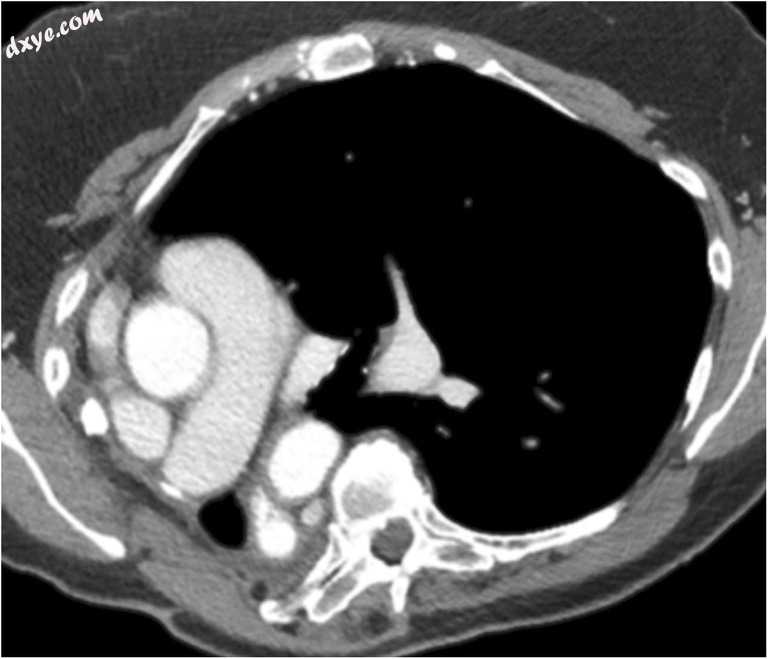
图11
一名55岁的女性右肺上叶腺癌在右肺切除术后延伸至肺门状态。 随访监测CECT显示纵隔移位,左肺疝进入右半胸
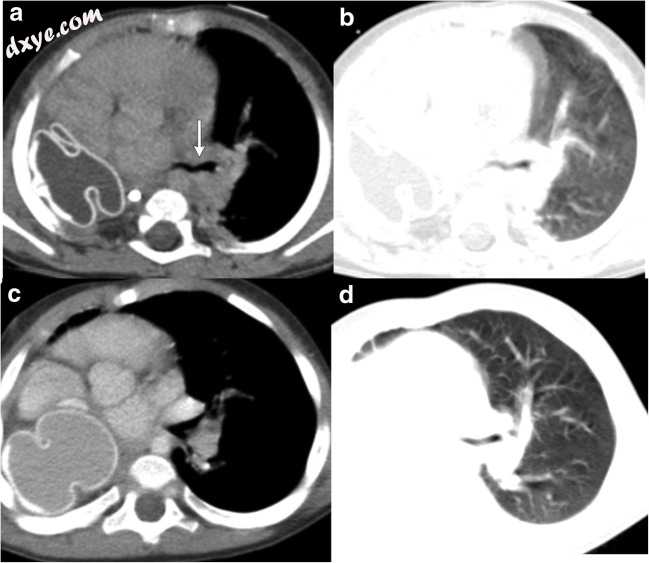
图12
a-d一名5岁儿童,1岁时患右肺和弯刀综合征的右肺切除病史,现在患有逐渐增加的呼吸困难。轴向CECT显示右侧胸腔内的组织扩张器,其在初始手术时放置(a,b)。此外,还观察到左支气管狭窄,可能是肺切除术后综合征的原因(白色箭头)。后右轴向CECT(c,d)与右半胸中增大的组织扩张器表现出左支气管狭窄的减少。在成长中的儿童中,这些组织扩张器可能需要随着时间的推移而增大以防止这些症状
经膈疝
膈肌呈圆顶状结构,中央肌腱和周围肌纤维分为三组:腰椎间盘突出,肋骨和胸骨。肌层之间的间隙仅由胸膜,腹膜和筋膜层覆盖,导致潜在的无力部位[30]。膈疝可以是纵隔或胸膜内[31]。纵隔经膈疝可位于血管前空间(Morgagni和Larry的空间​​)或内脏室(心包疝,食管裂孔疝)[35]。 Bochdalek疝是胸膜内疝的一个例子。创伤后疝可能不遵循这些严格的界限,因为它们可能由膈肌的纵隔和胸膜部分的撕裂引起。
Morgagni疝
Morgagni疝的特征是在横膈膜右侧的肋骨和胸骨之间的空间中存在小的解剖学缺陷。这个潜在的空间,也称为胸肋三角,以胸骨,横膈膜和心包为边界,包含胸内血管和淋巴管(图13a)。先天性Morgagni疝的发病率<3%的活产[32]和12%的婴儿期膈肌缺陷[33]。隔膜左侧的类似间隙是拉里的空间(图13b,c)。无论偏侧性如何,这些都称为Morgagni疝。
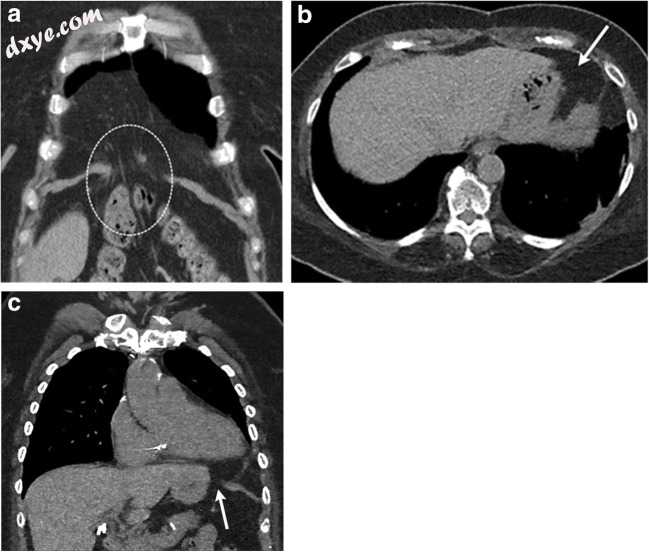
图13
a一名46岁女性在评估肺炎时获得的胸部X线片上评估了右心膈角混浊。胸廓的冠状CECT通过右前内侧膈膜(a)的明显缺损识别大网膜(虚线圆圈)的突出,与Morgagni疝一致。 b,c创伤后49岁的急诊科病人。仰卧胸部X线片可疑纵隔扩大。轴向(b)和冠状位(c)CT清楚地显示左前内侧膈肌(白色箭头)的局灶性缺损,腹膜脂肪疝入心包
在CXR上,Morgagni疝在心脏膈角处表现为不透明。鉴别诊断包括突出的脂肪垫,淋巴结病和支气管或心包囊肿。在CT上,胸肋三角区的缺陷通常被识别为包含成人的网膜,但它可能包含儿童的肝脏,肠袢或胃。 MRI用于具有挑战性的病例,并将突出的内容区分为肝脏与肿块或转移。
心包内膈疝
心包内膈疝是罕见的,主要是间接性钝性创伤的后遗症[34]。腹部内容物可以通过这种撕裂疝入心包。 CXR可以识别胸骨后空气或肠袢。 CT可以确认突出的胃或其他肠环(图14a)。肝脏可以疝入心包,并在超声心动图上模拟心包质量。具有对比度的CT可以准确地识别诸如肝脏的突出的内脏(图14b)。 MRI具有高的空间和时间分辨率,不仅可以帮助表征这种心包质量,还可以帮助评估任何相关的心包约束。
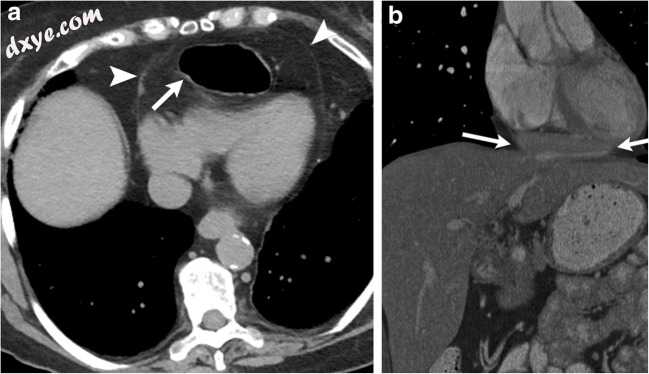
图14
a一名44岁男性,近期有腹部钝性创伤史,目前正向急诊室报告上腹部疼痛。具有口腔对比的轴向CT将胃的突出(白色箭头)识别为心包(箭头),对右心室具有轻微的质量效应。 b一名56岁男性,腹部钝性创伤史,近期诊断为霍奇金淋巴瘤。在最近的超声心动图上确定了心包肿块。冠状位CECT识别心包中肝左叶的突出(白色箭头)。右心室的质量效应最小
食管裂孔疝
食管裂孔疝(HH)通过食管裂孔缺损代表胃进入胸腔[35]。食管裂孔疝是成人最常见的膈疝。据估计,> 50岁以上的西部人群中> 50%的成年人患有这些疝气[36,]。裂孔疝有四种类型;这些可以在UGI,CT和MRI上识别。 I型或滑动裂孔疝代表最常见的类型,其中由于膈 - 食管膜的弱点而存在胃 - 食管连接的胸内迁移(图15a)。在II型HH中,胃 - 食管连接处保持在膈膜下方,而胃底部从膈 - 食管膜中的局灶性缺损疝入胸腔。 III型HH是复合疝,其中膈 - 食管膜不仅被削弱和拉伸,而且该膜的前外侧部分也存在缺陷。这导致胃 - 食道连接和胃底突出进入胸腔(图15b)。这些是食管疝的最常见形式,可能与胃旋转有关。 IV型疝的特征在于III型疝以及其他腹部器官的突出,其可包括胰腺,脾和肝(图15c)。
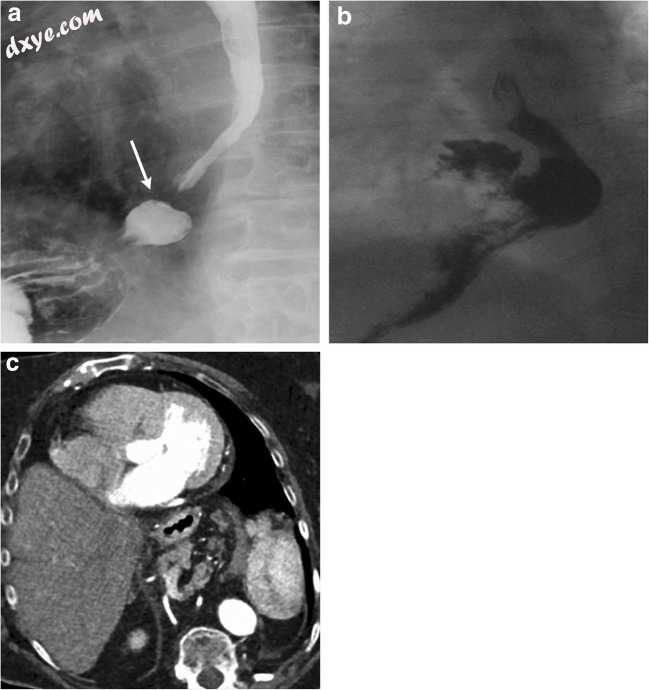
图15
a一名79岁的女性,在晚餐后躺下(h / o)胃灼热史。对比食管造影左前倾斜投影确定胃食管连接处(白色箭头)突出到胸腔中;发现与I型或滑动裂孔疝一致。 b一名72岁男性患有病态肥胖和复发性反流性肺炎。钡食管造影的侧向投影确定胃 - 胃食管与胃底的交界处的胸内突出,与III型或混合的食管下食管裂孔疝一致。 c一位78岁的女性接受经导管主动脉瓣置换术的术前评估。轴向对比CT识别疝囊中含有胃,大肠,脾血管和胰腺的大型裂孔疝,与IV型裂孔疝相容(电影2)
Bochdalek疝
Bochdalek疝发生在腰椎间盘突出症和肋骨中,并且在左侧更常见。这些是最常见的先天性膈疝,估计每2000-5000例活产的发病率为1 [33]。在成人中,Bochdalek疝通常被少报,并且可以在0.17%[37]至6%[38]的患者中被识别。获得性疝气代表隔膜中的缺陷或撕裂。具有较大缺损的膈疝在钝性创伤后获得的可能性较高,或者在瘫痪或薄的膈肌中发生剧烈的咳嗽而不是膈肌中的先天性缺陷。
当在胸腔中看到胃或肠环时,可以在常规产前美国(图16a)上识别这些疝气。产前MRI可用于确认缺陷和评估肺成熟度(图16b)。它们可能与同侧肺发育不全有关。通常腹部内容物由于腹内压力较高而延伸穿过隔膜进入胸腔。隔膜中较大的缺陷可导致肠袢和网膜突出进入纵隔。
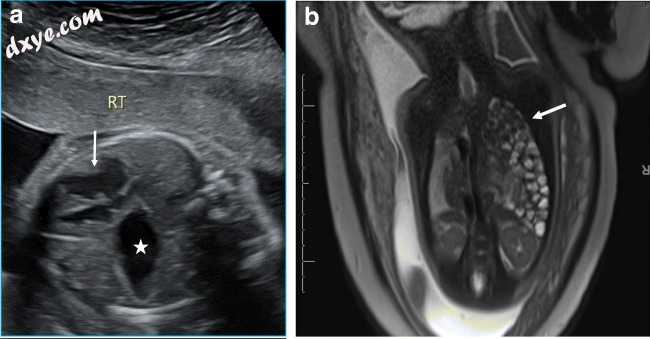
图16
一个21周大的胎儿的轴向超声图像识别胸腔中心脏(白色箭头)的胃(星)。这一发现提示先天性膈疝。 b在产前MRI(b)上看到的冠状图像显示多个充满液体的肠(白色箭头)环延伸到左胸顶,与Bochdalek疝相容。有相关的同侧肺发育不全
创伤后膈疝
钝性创伤引起的膈肌损伤可导致中央肌腱和/或肌纤维中的复杂撕裂。这可能导致腹部内容物突出进入胸腔;这通常在临床上隐匿,但在CT或MRI上偶然发现。评估膈肌损伤的CT征象可以是直接或间接的。
指示标志是:
节段性膈肌缺损:当膈肌连续性失去焦点时。
悬挂隔膜标志:撕裂隔膜的自由边缘向内卷曲。这形成了软组织衰减曲线结构。
没有隔膜标志:在隔膜预期可清楚识别的区域中没有横隔膜。
间接标志是:
腹腔脏器或腹膜脂肪突出进入胸膜或心包腔。
衣领征:膈肌缺损部位突出结构的腰部收缩。衣领标志的变体是驼峰标志,其指的是位于隔膜水平上方的突出肝脏的形状。在轴向CT图像上,可以看到带状符号,其对应于线性低衰减,其横切膈膜边缘之间的突出肝脏。
依赖性内脏征:这表示突出的腹部器官和胸壁之间的直接接触,没有任何肺部插入。
升高的腹部器官征象:这是由于腹部结构位于膈肌水平以上而产生的。 Nchimi等。 [13,23]建议使用右侧膈肌升高>左侧膈肌水平以上5 cm作为右侧阈值,左侧膈肌升高>右侧膈肌水平> 4 cm作为左侧阈值膈肌破裂。
偶尔会出现膈疝的延迟表现,其中小的初始撕裂随着时间的推移逐渐扩大,随后将腹内内容物突出到胸腔中[图17a,b] [39]。
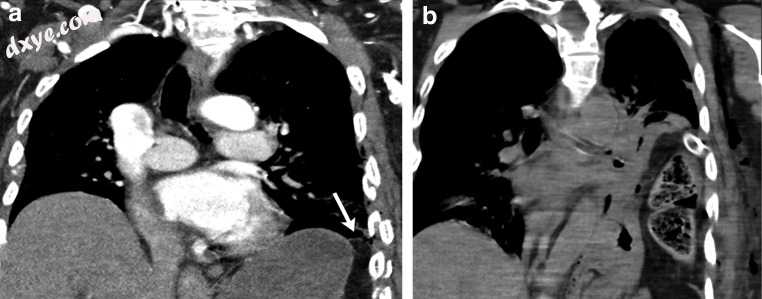
图17
a,b一名80岁的男性,在发生机动车事故后胸部和腹部有钝的创伤。冠状对比CT(b)识别多个左肋骨折。另外,左侧膈肌的侧面存在局灶性缺陷(白色箭头)。 2天后患者出现呼吸急促和额叶照片新的不透明度。来自随访CT(b)的冠状位图像确定左侧膈肌缺损的间隔增大,其中胃,脾曲和网膜新突出到左胸腔中。对此疝进行了急诊手术修复
腹壁疝胸廓延长
腹壁疝可以通过胸膜的浅层或深层延伸到膈肌水平以上,并作为浅表胸壁疝出现。这些疝气可以来自腹侧腹壁或侧腹壁。腰疝通过第12肋骨和髂嵴之间的缺陷而发生,并且通常是先前创伤或手术的后遗症(图18a)。切口疝可见于中腹前壁,通常是腹部手术的晚期并发症(图18b)。
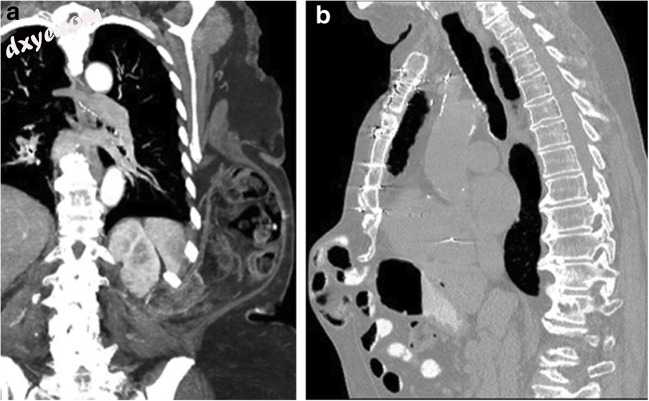
图18
a一名80岁女性正在接受经导管主动脉瓣置换治疗严重主动脉瓣狭窄的评估。来自对比增强CT的冠状最大强度投影图像显示出大的左侧腹壁疝,其起源于腰三角。疝囊宽,包含小肠,大肠和网膜。它延伸到胸廓的皮下筋膜直到左侧第6肋骨的水平。 b一名患有立体定向放射治疗的77岁男性肺癌患者。为监测获得的矢状CECT显示大的前腹壁疝,皮下延伸到前胸廓前剑突部分
胸疝的并发症
胸疝的并发症包括创伤,阻塞,嵌顿和勒死。胸壁疝中的突出内容也因轻微创伤而受伤的风险增加。在突出的肠环或胃中可见梗阻。嵌顿疝的特征是由于颈部狭窄而出现束缚疝,并表明疝囊的内容是不可减少的[40,41]。
在肠疝的情况下,狡窄易导致勒死和阻塞。最初,淋巴管存在角度和扭曲,其次是疝气颈部的静脉和动脉,这可能导致淋巴和静脉阻塞。在CT上,突出的内脏可能出现扩大,水肿,低密度和对比度增强。如果不及时治疗,可导致完全动脉闭塞和嵌顿。需要对急性动脉闭塞的绞窄性疝进行治疗;否则会导致缺血和坏死[41]。
胸疝的并发症可以用疝气含量来描述。
肺
嵌顿的肺疝呈现为不可还原的,界限清楚的凸起。 在CT上,呼吸道口径的变化(图(图4a)4a)或肺血管的突然变窄表明肺部突出即将发生狡窄。 肺实质的绞窄是罕见的,但已在病例报告中进行了描述[42]。 支气管突然变窄或疝气颈部肺血管口径的变化可能是暗示CT即将发生狡窄的迹象。 血栓可能存在于肺动脉分支(图19)中,导致绞窄的肺段。
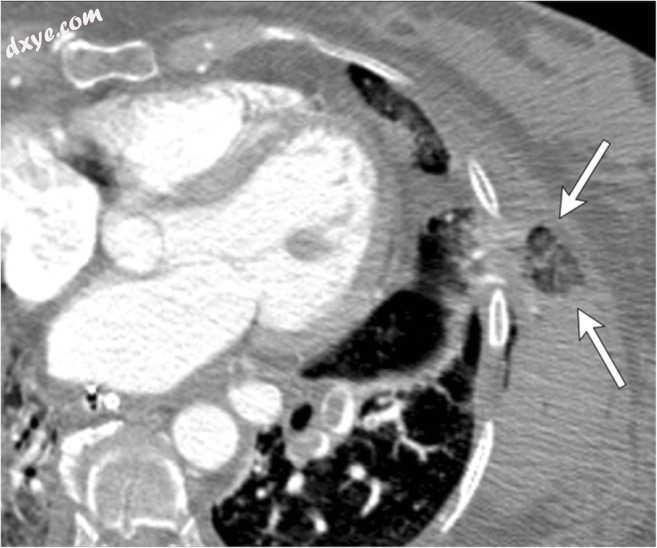
图19
最近一次肺移植后,一名48岁新发病人左胸壁疼痛。左肋间绞窄性肺疝。左肺移植患者的轴向CECT图像。局灶性突出的左肺下侧部分是绞合的(箭头),导致其不均匀的混浊。左下叶前段的舌和肺段肺不张的磨玻璃影响也可继发于左下肺动脉栓塞
胃
突出的胃的并发症包括嵌顿,勒死和肠扭转。胃扭转可以是有机轴或肠系膜。在有机轴扭转中,旋转沿着胃的长轴发生,而在肠系膜肠扭转中,旋转垂直于胃的长轴,移位的胃窦优于GE结。胃旋转或扭转> 180°可导致狡窄和阻塞[43]。有机体扭转在食管裂孔疝中更常见,并且窒息和坏死的发生率很高[44]。胃的有机轴定位是指在没有胃阻塞的情况下部分旋转<180°。
在CXR上,可以看到两个心脏空气液体水平。在UGI上,对有机轴扭转的诊断结果包括胸内胃,其具有GE结的较低位置和下方定向的幽门,具有较大和较小曲率的反向位置。此外,无法通过口胃管或口腔对比度超过胃的失败表明旋转> 180°和胃阻塞。通常在UGI之前获得CT并且可以识别突出的胸内胃和肺气肿并定位胃梗阻的转变点。对比增强CT还可以识别由于灌注不足和狡窄导致的胃壁增强减少(图20a,b)。
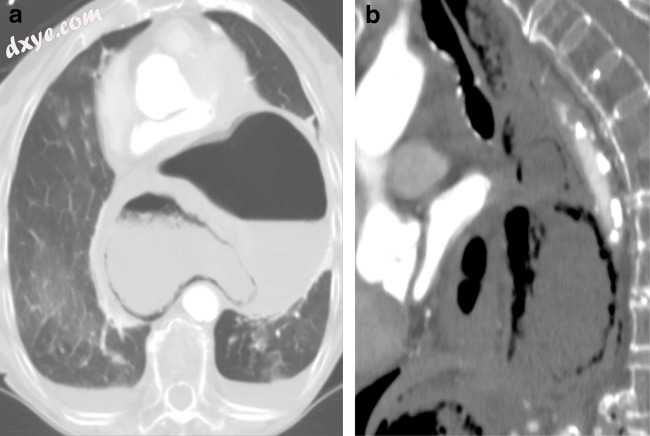
图20
a,b一名92岁女性,患有严重的上腹部疼痛,呕吐和恶心。 矢状(a)和轴(b)对比CT胸部(双排除)显示胸腔内胃有机轴扭转和胃气肿(电影3)需要紧急手术修复
肠
突出的肠可以经历闭环阻塞。 在这种情况下,CT可以识别肠壁增厚,异常壁增强,血管充血和肺气肿。 游离流体,肠壁增厚和膨胀的存在代表阻碍绞窄。 在患有慢性疝的患者中,可以在具有纤维化的疝囊中形成粘连。 这可导致突出的胃或肠环的缓慢进行性阻塞,其可表现为急性 - 慢性阻塞(图21a,b)。
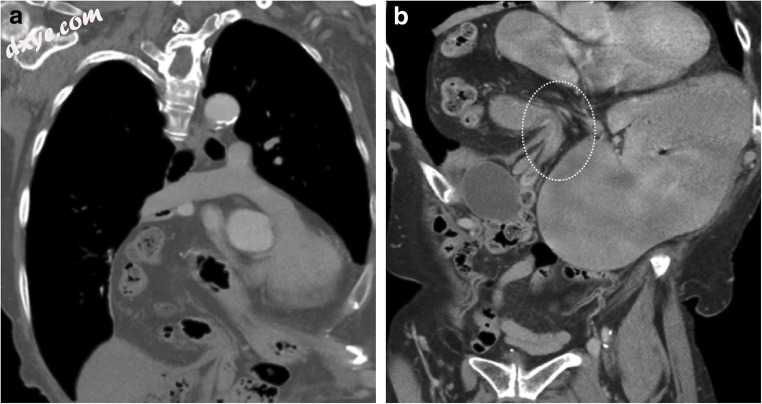
图21
a,b 86岁男性,有(h / o)黑色素瘤病史,现有慢性右上腹痛。冠状对比CT(a)确定右侧胸骨膈疝。注意疝囊狭窄的颈部,胃(体,幽门和胃窦),结肠和网膜突出进入纵隔。这是一个被绞窄的疝气。该患者接受了选择性修复,但被拒绝了。同一患者在2个月后出现新发急性右上腹疼痛。冠状对比增强CT(b)表明胃出口梗阻严重扩张(电影4)。突出的肝弯曲不扩张。疝囊内的粘连可导致肠梗阻和变窄。这些需要通过放置胃管然后手术修复来对扩张的胃进行紧急减压
腹部内脏
肺,肾,脾,肠等的突出,通过小的缺陷可导致阻塞,血管受损,绞窄和缺血。通过狭窄的颈部急性疝可增加血管压迫和疝状腹部器官和肠道的窒息风险。在肾脏或脾脏等实体器官的内脏突出的情况下,在动脉阻塞之前可能发生静脉压迫和阻塞(图22)。输尿管疝可通过先天性或后天性膈肌缺损引起肾积水(图23a,b)。
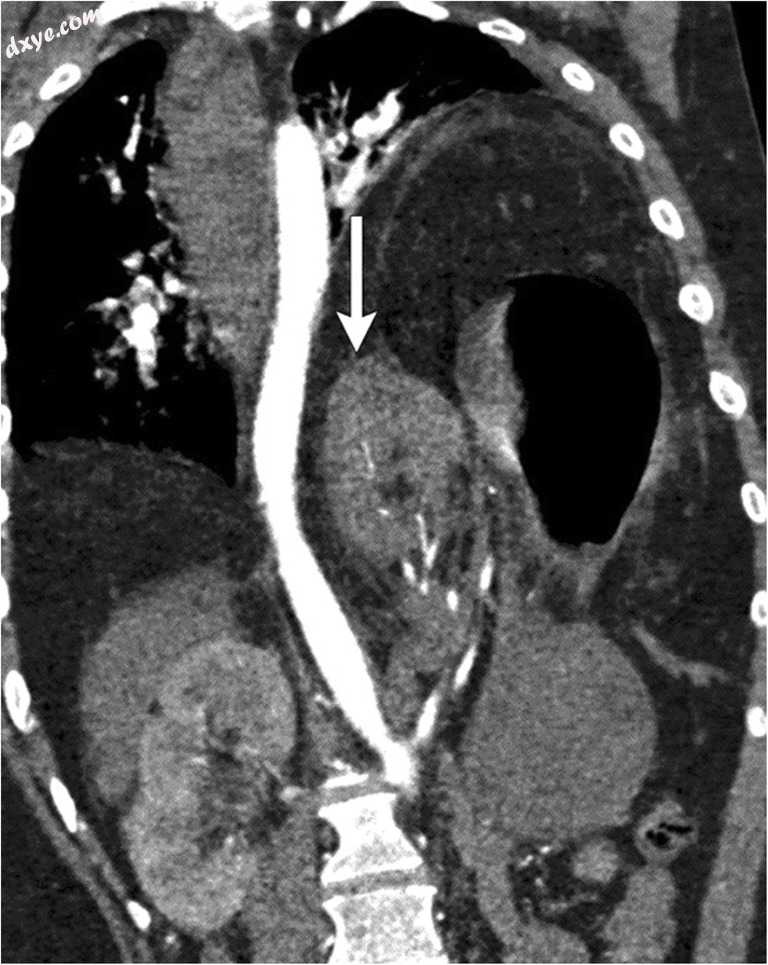
图22
一名31岁的患者因卧床休息导致下肢骨折,现在因严重的咳嗽而出现新发胸痛。 冠状对比CT显示左侧膈疝大,左侧胸部存在左肾,胃和网膜。 注意在这些动脉期图像上与右肾相比,左肾(白色箭头)的增强减少。 肾动脉正常; 在这些动脉期图像上不能评估肾静脉。 术中发现与这些发现一致,表明左侧肾静脉狭窄,膈肌缺损处有静脉充血(电影5)
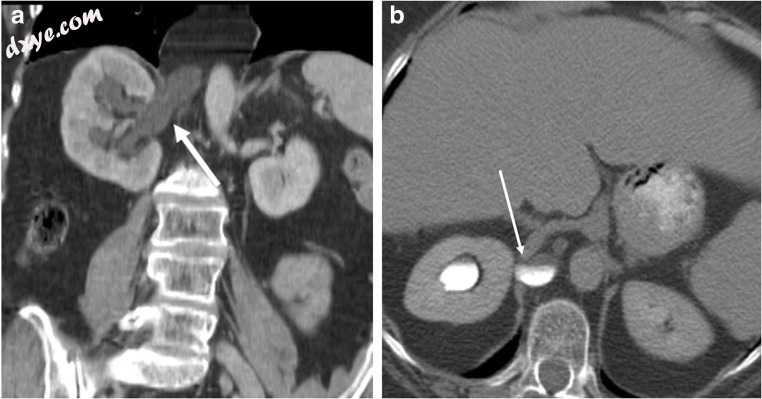
图23
a,b冠状动脉(a)静脉期和轴向延迟排泄期(b)来自患有水肿的患者的CT确定右后膈肌(白色箭头)的局灶性缺损,右侧输尿管突出进入胸腔。疝气的颈部有输尿管阻塞,导致肾积水
结论
胸疝可发生在胸腔入口,胸壁或横膈膜处。影像学,特别是CT,在确定诊断,表征类型,界定范围,确定内容,检测并发症和提供干预路线图方面发挥着重要作用。
参考:
Imaging of thoracic hernias: types and complications
1. Ginai AZ. Barium sulfate versus water-soluble, low-osmolarity contrast medium in esophageal examinations. Radiology. 1997;205(1):287–288. doi: 10.1148/radiology.205.1.287-a. [PubMed] [CrossRef] [Google Scholar]
2. Madan R, Bair RJ, Chick JF. Complex iatrogenic esophageal injuries: an imaging spectrum. AJR Am J Roentgenol. 2015;204(2):W116–W125. doi: 10.2214/AJR.14.12476. [PubMed] [CrossRef] [Google Scholar]
3. Chaturvedi A, Gange C, Sahin H, Chaturvedi A (2018) Incremental value of magnetic resonance imaging in further characterizing hypodense mediastinal and Paracardiac lesions identified on computed tomography. J Clin Imaging Sci 8:10 [PMC free article] [PubMed]
4. Su F, Zoole JB, Thompson RW, Meyers BF, Kuo E. Lung herniation after supraclavicular thoracic outlet decompression. Ann Thorac Surg. 2012;93(5):1720–1722. doi: 10.1016/j.athoracsur.2011.08.059. [PubMed] [CrossRef] [Google Scholar]
5. Rahman M, Buchan KG, Mandana KM, Butchart EG. Bilateral cervical lung hernia with T1 nerve compression. Ann Thorac Surg. 2006;81(2):716–718. doi: 10.1016/j.athoracsur.2004.10.018. [PubMed] [CrossRef] [Google Scholar]
6. Weissberg D, Refaely Y (2002) Hernia of the lung. Ann Thorac Surg 74(6):1963–1966 [PubMed]
7. Poellinger A, Lembcke AE, Elgeti T, Filimonov S, Enzweiler CN. Images in cardiovascular medicine. The cervical aortic arch: a rare vascular anomaly. Circulation. 2008;117(20):2716–2717. doi: 10.1161/CIRCULATIONAHA.107.755264. [PubMed] [CrossRef] [Google Scholar]
8. Moncada R, Shannon M, Miller R, White H, Friedman J, Shuford WH (1975) The cervical aortic arch. Am J Roentgenol Radium Ther Nucl Med 125(3):591–601 [PubMed]
9. Farsak B, Yilmaz M, Kaplan S, Böke E. Cervical aortic arch with aneurysm formation. Eur J Cardiothorac Surg. 1998;14(4):437–439. doi: 10.1016/S1010-7940(98)00206-1. [PubMed] [CrossRef] [Google Scholar]
10. Santamarina MG, Beddings I, Lermanda Holmgren GV, Opazo Sanchez H, Volpacchio MM. Multidetector CT for evaluation of the extrapleural space. Radiographics. 2017;37(5):1352–1370. doi: 10.1148/rg.2017160180. [PubMed] [CrossRef] [Google Scholar]
11. Bhalla M, Leitman BS, Forcade C, Stern E, Naidich DP, McCauley DI. Lung hernia: radiographic features. AJR Am J Roentgenol. 1990;154(1):51–53. doi: 10.2214/ajr.154.1.2104725. [PubMed] [CrossRef] [Google Scholar]
12. Athanassiadi K, Bagaev E, Simon A, Haverich A. Lung herniation: a rare complication in minimally invasive cardiothoracic surgery. Eur J Cardiothorac Surg. 2008;33(5):774–776. doi: 10.1016/j.ejcts.2008.01.027. [PubMed] [CrossRef] [Google Scholar]
13. Glenn C, Bonekat W, Cua A, Chapman D, McFall R (1997) Lung hernia. Am J Emerg Med 15(3):260–262 [PubMed]
14. Mirza A, Gogna R, Kumaran M, Malik M, Martin-Ucar AE (2011) The surgical management of intercostal lung herniation using bioprosthesis. J Surg Case Rep 2011(2):6 [PMC free article] [PubMed]
15. Losanoff JE, Richman BW, Jones JW. Recurrent intercostal herniation of the liver. Ann Thorac Surg. 2004;77(2):699–701. doi: 10.1016/S0003-4975(03)00749-5. [PubMed] [CrossRef] [Google Scholar]
16. Olbrecht VA, Barreiro CJ, Bonde PN et al (2006) Clinical outcomes of noninfectious sternal dehiscence after median sternotomy. Ann Thorac Surg 82(3):902–907 [PubMed]
17. Hayward RH, Knight WL, Reiter CG (1994) Sternal dehiscence. Early detection by radiography. J Thorac Cardiovasc Surg 108(4):616–619 [PubMed]
18. Boiselle PM, Mansilla AV. A closer look at the midsternal stripe sign. AJR Am J Roentgenol. 2002;178(4):945–948. doi: 10.2214/ajr.178.4.1780945. [PubMed] [CrossRef] [Google Scholar]
19. Chang EI, Festekjian JH, Miller TA, Ardehali A, Rudkin GH. Chest wall reconstruction for sternal dehiscence after open heart surgery. Ann Plast Surg. 2013;71(1):84–87. doi: 10.1097/SAP.0b013e31824872d9. [PubMed] [CrossRef] [Google Scholar]
20. Nasser WK. Congenital diseases of the pericardium. Cardiovasc Clin. 1976;7(3):271–286. [PubMed] [Google Scholar]
21. Clark DE, Wiles CS, 3rd, Lim MK, Dunham CM, Rodriguez A. Traumatic rupture of the pericardium. Surgery. 1983;93(4):495–503. [PubMed] [Google Scholar]
22. Shah AB, Kronzon I. Congenital defects of the pericardium: a review. Eur Heart J Cardiovasc Imaging. 2015;16(8):821–827. doi: 10.1093/ehjci/jev119. [PubMed] [CrossRef] [Google Scholar]
23. Wang ZJ, Reddy GP, Gotway MB, Yeh BM, Hetts SW, Higgins CB (2003) CT and MR imaging of pericardial disease. Radiographics 23(Spec No):S167–S180 [PubMed]
24. Jeung MY, Gasser B, Gangi A et al (2002) Imaging of cystic masses of the mediastinum. Radiographics 22(Spec No):S79–S93 [PubMed]
25. Maiuri F, Corriero G, Giampaglia F, Simonetti L. Lateral thoracic meningocele. Surg Neurol. 1986;26(4):409–412. doi: 10.1016/0090-3019(86)90147-3. [PubMed] [CrossRef] [Google Scholar]
26. Sukumaran M, Berger HW (1979) Mediastinal herniation of the pleural sac: occurrence in massive pleural effusion. Chest 75(3):382–383 [PubMed]
27. Singh S, Singh N, Singh V. Trans-mediastinal herniation of bulla: semilunar sign. Lung India. 2015;32(6):611–613. doi: 10.4103/0970-2113.168128. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
28. Chae EJ, Seo JB, Kim SY et al (2006) Radiographic and CT findings of thoracic complications after pneumonectomy. Radiographics 26(5):1449–1468 [PubMed]
29. Shepard JA, Grillo HC, McLoud TC, Dedrick CG, Spizarny DL (1986) Right-pneumonectomy syndrome: radiologic findings and CT correlation. Radiology 161(3):661–664 [PubMed]
30. Sandstrom CK, Stern EJ. Diaphragmatic hernias: a spectrum of radiographic appearances. Curr Probl Diagn Radiol. 2011;40(3):95–115. doi: 10.1067/j.cpradiol.2009.11.001. [PubMed] [CrossRef] [Google Scholar]
31. Mehollin-Ray AR, Cassady CI, Cass DL, Olutoye OO (2012) Fetal MR imaging of congenital diaphragmatic hernia. Radiographics 32(4):1067–1084 [PubMed]
32. Comer TP, Clagett OT. Surgical treatment of hernia of the foramen of Morgagni. J Thorac Cardiovasc Surg. 1966;52(4):461–468. [PubMed] [Google Scholar]
33. Chavhan GB, Babyn PS, Cohen RA, Langer JC (2010) Multimodality imaging of the pediatric diaphragm: anatomy and pathologic conditions. Radiographics 30(7):1797–1817 [PubMed]
34. Meng RL, Straus A, Milloy F, Kittle CF, Langston H (1979) Intrapericardial diaphragmatic hernia in adults. Ann Surg 189(3):359–366 [PMC free article] [PubMed]
35. Abbara S, Kalan MM, Lewicki AM. Intrathoracic stomach revisited. AJR Am J Roentgenol. 2003;181(2):403–414. doi: 10.2214/ajr.181.2.1810403. [PubMed] [CrossRef] [Google Scholar]
36. Mittal RK. Hiatal hernia: myth or reality? Am J Med. 1997;103(5A):33S–39S. doi: 10.1016/S0002-9343(97)00318-5. [PubMed] [CrossRef] [Google Scholar]
37. Mullins ME, Stein J, Saini SS, Mueller PR (2001) Prevalence of incidental Bochdalek's hernia in a large adult population. AJR Am J Roentgenol 177(2):363–366 [PubMed]
38. Gale ME. Bochdalek hernia: prevalence and CT characteristics. Radiology. 1985;156(2):449–452. doi: 10.1148/radiology.156.2.4011909. [PubMed] [CrossRef] [Google Scholar]
39. Lal S, Kailasia Y, Chouhan S, Gaharwar APS, Shrivastava GP (2011) Delayed presentation of post traumatic diaphragmatic hernia. J Surg Case Rep 2011(7):6 [PMC free article] [PubMed]
40. Aguirre DA, Casola G, Sirlin C. Abdominal wall hernias: MDCT findings. AJR Am J Roentgenol. 2004;183(3):681–690. doi: 10.2214/ajr.183.3.1830681. [PubMed] [CrossRef] [Google Scholar]
41. Kingsnorth AN, LeBlanc KA (2013) Management of abdominal hernias. Springer, London
42. Detorakis EE, Androulidakis E. Intercostal lung herniation—the role of imaging. J Radiol Case Rep. 2014;8(4):16–24. [PMC free article] [PubMed] [Google Scholar]
43. Peterson CM, Anderson JS, Hara AK, Carenza JW, Menias CO (2009) Volvulus of the gastrointestinal tract: appearances at multimodality imaging. Radiographics 29(5):1281–1293 [PubMed]
44. Carter R, Brewer LA 3rd, Hinshaw DB (1980) Acute gastric volvulus. A study of 25 cases. Am J Surg 140(1):99–106 [PubMed] |


